题目内容
17.现有反应:mA(g)+nB(g)?pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:(1)该反应的正反应为吸热反应,且m+n>p(填“>”、“=”或“<”).
(2)若容积不变加入B,则A的转化率增大,B的转化率减小.
(3)若升高温度,则平衡时B、C的浓度之比$\frac{c(B)}{c(C)}$将减小.
分析 (1)当升高温度时,B的转化率变大,说明平衡向正反应移动,升高温度平衡向吸热反应移动;
减小压强时,混合体系中C的质量分数也减小,平衡向逆反应移动,减小压强平衡向气体体积增大的方向移动;
(2)加入B(体积不变)平衡向正反应移动,其它反应物的转化率增大,而其自身转化率降低;
(3)升高温度平衡向正反应移动,平衡时B的浓度降低,C的浓度增大.
解答 解:(1)当升高温度时,B的转化率变大,说明平衡向正反应移动,升高温度平衡向吸热反应移动,故正反应是吸热反应;
减小压强时,混合体系中C的质量分数也减小,平衡向逆反应移动,减小压强平衡向气体体积增大的方向移动,即m+n>p,
故答案为:吸;>;
(2)若容积不变加入B,平衡向着正反应方向移动,A的转化率增大;由于加入了B,导致B自身转化率减小,
故答案为:增大;减小;
(3)升高温度平衡向正反应移动,平衡时B的浓度降低,C的浓度增大,则$\frac{c(B)}{c(C)}$的比值将减小,
故答案为:减小;
点评 本题考查了化学平衡的计算,题目难度不大,明确化学平衡及其影响为解答关键,(2)为易错点,注意加入了B,导致B的转化率减小,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
17.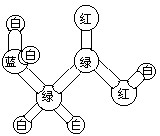 如图是某分子的球棍模型图.图中“棍”代表单键、双键或三键.不同颜色的球代表不问元素的原子,该模型图可代表一种( )
如图是某分子的球棍模型图.图中“棍”代表单键、双键或三键.不同颜色的球代表不问元素的原子,该模型图可代表一种( )
 如图是某分子的球棍模型图.图中“棍”代表单键、双键或三键.不同颜色的球代表不问元素的原子,该模型图可代表一种( )
如图是某分子的球棍模型图.图中“棍”代表单键、双键或三键.不同颜色的球代表不问元素的原子,该模型图可代表一种( )| A. | 卤代羧酸 | B. | 酯 | C. | 氨基酸 | D. | 醇 |
18.下列实验对应的现象及结论均正确且两者具有因果关系的选项是( )
| 选项 | 实验 | 现象 | 结论 |
| A | SO2通入BaCl2溶液,然后滴入稀硝酸 | 有白色沉淀,白色沉淀不溶于稀硝酸 | 所得沉淀为BaSO3,后转化为BaSO4 |
| B | 用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热 | 熔化后的液态铝滴落下来 | 金属铝的熔点较低 |
| C | 将稀硫酸滴入碳酸钠溶液中产生的气体通入硅酸钠溶液 | 有白色沉淀生成 | 证明非金属性S>C>Si |
| D | 向含有淀粉的FeI2溶液中滴加足量的氯水 | 溶液变蓝 | 还原性:I->Fe2+ |
| A. | A | B. | B | C. | C | D. | D |
2.在一固定容积的密闭容器中发生如下反应CO(g)+H2O(g)?CO2(g)+H2(g).当充人lmolH2O(g)和1molCO (g)反应达到平衡时,有$\frac{1}{2}$的CO转化为CO2.在相同条件下,若将1molCO(g)和2mol H2O(g)重新充入同一反应容器中,当反应达到平衡后,混合气体中CO2的体积分数可能为( )
| A. | 11.1% | B. | 22.2% | C. | 33.3% | D. | 37.8% |
9.环己酮是一种重要的有机化工原料.实验室合成环己酮的反应如下:
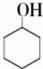 $→_{Na_{2}Cr_{2}O_{7}+H_{2}SO_{4}}^{55℃~69℃}$
$→_{Na_{2}Cr_{2}O_{7}+H_{2}SO_{4}}^{55℃~69℃}$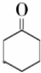
环己醇和环己酮的部分物理性质见下表:
现以20mL环己醇与足量Na2Cr2O7和硫酸的混合液充分反应,制得主要含环己酮和水的粗产品,然后进行分离提纯.
分离提纯过程中涉及到的主要步骤有(未排序):
a.蒸馏,除去乙醚后,收集151℃~156℃馏分;
b.水层用乙醚(乙醚沸点34.6℃,易燃烧)萃取,萃取液并入有机层;
c.过滤;
d.往液体中加入NaCl固体至饱和,静置,分液;
e.加入无水MgSO4固体,除去有机物中少量水.
回答下列问题:
(1)上述分离提纯步骤的正确顺序是d b e c a(填字母).
(2)b中水层用乙醚萃取的目的是使水层中少量的有机物进一步被提取,提高产品的产量.
(3)以下关于萃取分液操作的叙述中,正确的是③.
①振荡几次后需打开分液漏斗上口的玻璃塞放气
②经几次振荡并放气后,手持分液漏斗静置待液体分层
③分液时,需先将上口玻璃塞打开或玻璃塞上的凹槽对准漏斗口上的小孔,再打开旋塞待下层液体全部流尽时,再从上口倒出上层液体
(4)在上述操作d中,加入NaCl固体的作用是降低环己酮的溶解度,增加水层的密度,有利于分层.蒸馏除乙醚的操作中采用的加热方式为水浴加热.
(5)蒸馏操作时,一段时间后发现未通冷凝水,应采取的正确方法是停止加热,冷却后通自来水.
(6)恢复至室温时,分离得到纯产品体积为 12mL,则环己酮的产率约是60%.
 $→_{Na_{2}Cr_{2}O_{7}+H_{2}SO_{4}}^{55℃~69℃}$
$→_{Na_{2}Cr_{2}O_{7}+H_{2}SO_{4}}^{55℃~69℃}$
环己醇和环己酮的部分物理性质见下表:
| 物质 | 相对分子质量 | 沸点(℃) | 密度(g•cm-3,20℃) | 溶解性 |
| 环己醇 | 100 | 161.1 | 0.9624 | 能溶于水和醚 |
| 环己酮 | 98 | 155.6 | 0.9478 | 微溶于水,能溶于醚 |
分离提纯过程中涉及到的主要步骤有(未排序):
a.蒸馏,除去乙醚后,收集151℃~156℃馏分;
b.水层用乙醚(乙醚沸点34.6℃,易燃烧)萃取,萃取液并入有机层;
c.过滤;
d.往液体中加入NaCl固体至饱和,静置,分液;
e.加入无水MgSO4固体,除去有机物中少量水.
回答下列问题:
(1)上述分离提纯步骤的正确顺序是d b e c a(填字母).
(2)b中水层用乙醚萃取的目的是使水层中少量的有机物进一步被提取,提高产品的产量.
(3)以下关于萃取分液操作的叙述中,正确的是③.
①振荡几次后需打开分液漏斗上口的玻璃塞放气
②经几次振荡并放气后,手持分液漏斗静置待液体分层
③分液时,需先将上口玻璃塞打开或玻璃塞上的凹槽对准漏斗口上的小孔,再打开旋塞待下层液体全部流尽时,再从上口倒出上层液体
(4)在上述操作d中,加入NaCl固体的作用是降低环己酮的溶解度,增加水层的密度,有利于分层.蒸馏除乙醚的操作中采用的加热方式为水浴加热.
(5)蒸馏操作时,一段时间后发现未通冷凝水,应采取的正确方法是停止加热,冷却后通自来水.
(6)恢复至室温时,分离得到纯产品体积为 12mL,则环己酮的产率约是60%.
6.在500℃时,把0.3mol SO2和0.2mol O2充入一个体积为10L并盛有V2O5(催化剂)的真空密闭容器中,保持温度不变,经2min后,容器内的压强不再变化,此时容器内压强减小20%.下列说法正确的是( )
| A. | 该温度下此反应的平衡常数K=400 | |
| B. | 其他条件不变,再充入0.3mol SO2和0.2mol O2平衡时,SO2的体积分数增大 | |
| C. | 平衡时,SO2的转化率为95% | |
| D. | 前2min SO2的平均反应速率0.02mol/(L•s) |