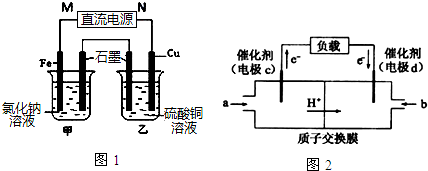
题目内容
12.下列有关说法正确的是( )| A. | 普通锌锰干电池中的MnO2在工作时起催化作用 | |
| B. | 若1mol Na2O2与足量水反应产生O2,理论上转移的电子数约为2×6.02×1023 | |
| C. | 室温下,体积、pH均相同的HA和HB两种酸分别与足量的锌反应,HA放出氢气多,说明酸性:HB>HA | |
| D. | 恒温恒压密闭容器中进行的反应N2(g)+3H2(g)?2NH3(g)△H=-a kJ•mol-1,平衡时向容器中再充入一定量NH3,重新达平衡时a值不变 |
分析 A、普通锌锰干电池中的MnO2在工作时,锰元素的化合价降低,得电子;
B、Na2O2与足量水反应是自身的氧化还原反应,1mol Na2O2转移1mol的电子;
C、等体积pH均相同HA和HB两种酸分别与足量的锌反应,HA放出气体多,则HA的浓度大;
D、在N2(g)+3H2(g)?2NH3(g)△H=-a kJ•mol-1,a表示1mol的氮气和3mol的氢气完全转化为2mol的氨气放出的热量.
解答 解:A、普通锌锰干电池中的MnO2在工作时,锰元素的化合价降低,得电子是氧化剂,而不是催化剂,故A错误;
B、Na2O2与足量水反应是自身的氧化还原反应,1mol Na2O2转移1mol的电子,所以理论上转移的电子数约为6.02×1023,故B错误;
C、等体积pH=3的HA和HB两种酸分别与足量的锌反应,HA放出气体多,则HA的浓度大,HA为弱酸,所以酸性HB>HA,故C正确;
D、在N2(g)+3H2(g)?2NH3(g)△H=-a kJ•mol-1,a表示1mol的氮气和3mol的氢气完全转化为2mol的氨气放出的热量,与平衡的移动无关,所以a是一定值,故D正确;
故选CD.
点评 本题是综合考查题,涉及氧化还原反应电子的转移、酸性比较及pH与浓度的关系、原电池等,把握化学原理和热化学方程式的意义,题目难度不大.

练习册系列答案
相关题目
2.下列说法正确的是( )
| A. | 盐类发生水解的过程中,溶液的pH一定发生改变 | |
| B. | 向K2CO3溶液中通入CO2可使溶液中的c(CO32-)变大 | |
| C. | 向Na2SO3溶液中通入Cl2,溶液的导电性变强 | |
| D. | 一定温度下的密闭容器中,反应2NO2?N2O4达平衡时,再加入1molN2O4,平衡正向移动,且N2O4含量增大 |
3.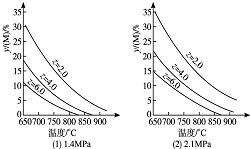 反应aM(g)+bN(g)?cP(g)+dQ(g)达到平衡时,M的体积分数y(M)与反应条件的关系如图所示.其中z表示反应开始时N的物质的量与M的物质的量之比.下列说法不正确的是( )
反应aM(g)+bN(g)?cP(g)+dQ(g)达到平衡时,M的体积分数y(M)与反应条件的关系如图所示.其中z表示反应开始时N的物质的量与M的物质的量之比.下列说法不正确的是( )
 反应aM(g)+bN(g)?cP(g)+dQ(g)达到平衡时,M的体积分数y(M)与反应条件的关系如图所示.其中z表示反应开始时N的物质的量与M的物质的量之比.下列说法不正确的是( )
反应aM(g)+bN(g)?cP(g)+dQ(g)达到平衡时,M的体积分数y(M)与反应条件的关系如图所示.其中z表示反应开始时N的物质的量与M的物质的量之比.下列说法不正确的是( )| A. | 同温同压同z时,加入催化剂,平衡时Q的体积分数不改变 | |
| B. | 同温同压时,增加z,平衡时Q的体积分数一定增加 | |
| C. | 同温同z时,增加压强,平衡时Q的体积分数一定减小 | |
| D. | 同压同z时,升高温度,平衡时Q的体积分数一定增加 |
20.在密闭容器中,A和B反应生成C,其反应速率分别用v(A)、v (B)、v (C)表示,已知它们之间的如下关系:3v (A)=2v (B),3v (C)=2v (B).则此反应可表示为( )
| A. | 3A+2B=2C | B. | 2A+3B=2C | C. | 3A+2B=3C | D. | A+B=C |
7.下列反应的生成物为纯净物的是( )
| A. | CH4与Cl2光照 | B. | 乙烯在催化剂的作用下生成聚乙烯 | ||
| C. | 乙烯和氯化氢加成 | D. | 新戊烷和Cl2光照 |