题目内容
4.绿矾(FeSO4•7H2O)在生活生产和科学研究上都有着广泛的应用.某研发小组在实验室利用废铁屑(含少量氧化铝、氧化铁)等物质通过下列流程制备绿矾: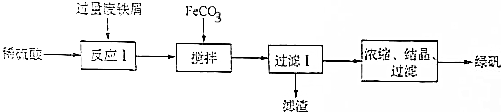
(1)实验过程中,搅拌、过滤都要用到的玻璃仪器有烧杯、玻璃棒.

(2)加入少量FeCO3的目的是为了调节溶液的pH,而使溶液中的某些金属阳离子转换成为相应的氢氧化物沉淀.
①溶液中有关金属离子转化为相应氢氧化物沉淀时,其浓度与溶液pH的关系如右图所示,则加入FeCO3调节溶液的pH时,溶液的pH应调节为5.0~5.8(填范围).过滤I所得滤渣的主要成分是Al(OH)3(填化学式)
②检验过滤I得到的滤液中是否含有CO32-离子的实验方法和结论是取少量滤液于试管中,滴加稀HCl,若有无色无味能使澄清石灰水变浑浊的气体产生,则证明滤液中含有CO32-,若无明显现象,则滤液中不含CO32-.
(3)绿矾在制备过程中易被部分氧化为硫酸铁.现取7.32g绿矾固体样品完全溶于稀盐酸后,加入足量的BaCl2溶液,充分反应、过滤得滤液和9.32g沉淀;在向滤液中通入112mL(标准状况)氯气恰好将其中的Fe2+全部氧化.
①7.32g该绿矾固体中,含FeSO4为0.01mol.
②试计算确定该绿矾固体的化学式.(写出计算过程)③根据所学知识,请给出制备绿矾过程中减少其中的FeSO4被氧化的措施加入过量铁屑,隔离空气.
分析 废铁屑(含少量氧化铝、氧化铁)等物质在稀硫酸中溶解得到溶液中含有硫酸亚铁、硫酸铁和硫酸铝,加入废铁屑过量的目的是利用铁还原溶液中的硫酸铁为硫酸亚铁,加入FeCO3搅拌调节溶液PH5.0-5.8使铝离子全部沉淀,亚铁离子不沉淀,过滤得到滤渣主要是氢氧化铝沉淀和过量的废铁屑,滤液为硫酸亚铁溶液通过浓缩、结晶、过滤得到绿矾晶体,
(1)溶解搅拌和过滤都用到的玻璃仪器有烧杯、玻璃棒;
(2)①加入少量FeCO3的目的是为了调节溶液的pH使铝离子全部沉淀生成氢氧化铝沉淀,亚铁离子不沉淀;
②通常用稀盐酸和澄清石灰水检验CO32-;
(3)根据沉淀9.32克为硫酸钡、氯气的物质的量计算出铁离子和亚铁离子的物质的量、再根据质量关系计算出含有的结晶水的质量,最后计算出晶体的化学式,防止生成的硫酸亚铁被氧化,应加入铁粉,隔离空气.
解答 解:(1)溶解搅拌和过滤都用到的玻璃仪器有烧杯、玻璃棒,
故答案为:玻璃棒;
(2)①加入少量FeCO3的目的是为了调节溶液的pH使铝离子全部沉淀生成氢氧化铝沉淀,亚铁离子不沉淀,则加入FeCO3调节溶液的pH时,溶液的pH应调节为
5-5.8使铝离子全部沉淀生成氢氧化铝,
故答案为:5.0~5.8,Al(OH)3;
②过滤Ⅰ得到的滤液是FeSO4溶液,检验滤液中含有CO32-的方法是取少量滤液于试管中,滴加稀HCl,若有无色无味能使澄清石灰水变浑浊的气体产生,则证明滤液中含有CO32-,若无明显现象,则滤液中不含CO32-,
故答案为:取少量滤液于试管中,滴加稀HCl,若有无色无味能使澄清石灰水变浑浊的气体产生,则证明滤液中含有CO32-,若无明显现象,则滤液中不含CO32-;
(3)硫酸钡的物质的量为:$\frac{9.32g}{233g/mol}$=0.04mol,即n(FeSO4)+3n(Fe2(SO4)3)=0.04mol,标况下112mL氯气的物质的量为:$\frac{112{×10}^{-3}L}{22.4L/mol}$=0.005mol,根据反应关系式2Fe2+~Cl2可知,硫酸亚铁的物质的量为:n(FeSO4)=n(Fe2+)=2n(Cl2)0.01mol,则3n(Fe2(SO4)3)=0.04mol-0.01mol=0.03mol,7.32克晶体中结晶水的质量为:m(H2O)=7.32g-152g/mol×0.01mol-400g/mol×0.01mol=1.8g,结晶水的物质的量为:n(H2O)=$\frac{1.8g}{18g/mol}$=0.1mol,所以绿矾晶体中硫酸亚铁、硫酸铁、水的物质的量之比为0.01mol:0.01mol:0.1mol=1:1:10,所以晶体的化学式为FeSO4•Fe2(SO4)3•10H2O,
①7.32g该绿矾固体中,含FeSO4为0.01mol,
故答案为:0.01;
②上述分析计算得到晶体的化学式为FeSO4•Fe2(SO4)3•10H2O,故答案为:FeSO4•Fe2(SO4)3•10H2O;
③在溶液中加入过量废铁屑可以防止亚铁离子被氧化,蒸发浓缩结晶过程中需要隔离空气,
故答案为:加入过量铁屑,隔离空气.
点评 本题考查了物质制备的实验过程分析,制备方法和试剂选择,注意离子分离的依据判断,掌握性质和实验过程和步骤是解题关键,题目难度中等.

 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案| A. | 已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,则H2SO4和Ba(OH)2的反应热△H=2×(-57.3)kJ•mol-1 | |
| B. | 燃料电池中将甲醇蒸气转化为氢气的热化学方程式是CH3OH(g)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g) △H=-192.9 kJ•mol-1,则CH3OH(g)的燃烧热为192.9 kJ•mol-1 | |
| C. | H2(g)的燃烧热是285.8 kJ•mol-1,则2H2O(g)═2H2(g)+O2(g)△H=+571.6 kJ•mol-1 | |
| D. | 葡萄糖燃烧热是2800 kJ•mol-1,则$\frac{1}{2}$C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l)△H=-1400 kJ•mol-1 |
| A. | 普通锌锰干电池中的MnO2在工作时起催化作用 | |
| B. | 若1mol Na2O2与足量水反应产生O2,理论上转移的电子数约为2×6.02×1023 | |
| C. | 室温下,体积、pH均相同的HA和HB两种酸分别与足量的锌反应,HA放出氢气多,说明酸性:HB>HA | |
| D. | 恒温恒压密闭容器中进行的反应N2(g)+3H2(g)?2NH3(g)△H=-a kJ•mol-1,平衡时向容器中再充入一定量NH3,重新达平衡时a值不变 |
| A. | 72.4% | B. | 77.8% | C. | 70% | D. | 30% |
| A. | 硫酸铜溶液 | B. | 较浓稀硫酸 | C. | 碳酸钠溶液 | D. | 硝酸银溶液 |

| A. | 正反应吸热,且B一定为气态 | |
| B. | 混合气体的平均摩尔质量随温度变化如图2所示 | |
| C. | 平衡后保持恒容,充入稀有气体,A的转化率增大 | |
| D. | 平衡后保持恒压,充入稀有气体,C的百分含量减小 |
 下图是盐酸与氢氧化钠溶液的滴定曲线a和b.
下图是盐酸与氢氧化钠溶液的滴定曲线a和b.