题目内容
1.在某一容积为2L的密闭容器内,加入0.8mol的H2和0.6mol的I2,在一定的条件下发生如下反应:H2(g)+I2(g)?2HI(g)+Q(Q>0)
反应中各物质的浓度随时间变化情况如图1:
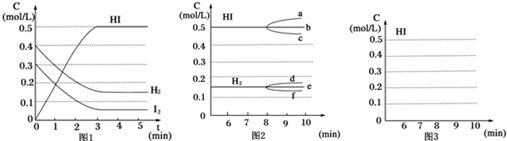
(1)根据图1数据,反应开始至达到平衡时,平衡速率v(HI)为0.167 mol/(L•min).
(2)反应达到平衡后,第8分钟时:
①若升高温度,化学平衡常数K减小(填写增大、减小或不变),HI浓度的变化正确的是c(用图2中a-c的编号回答)
②若加入I2,H2浓度的变化正确的是f.(用图2中d-f的编号回答)
(3)反应达到平衡后,第8分钟时,若把容器的容积扩大一倍,请在图3中画出8分钟后HI浓度的变化情况.
分析 (1)3min到达平衡,平衡时HI浓度变化为0.5mol/L,再根据v=$\frac{△c}{△t}$计算v(HI);
(2)①正反应为放热反应,升高温度平衡逆向移动,HI浓度减小;
②若加入I2,瞬间I2的浓度增大,H2、HI浓度不变,平衡正向移动,而后H2浓度减小;
的变化正确的是
(3)因为该反应前后化学计量数相等,所以,当反应达到平衡后将反容器容积扩大一倍,平衡不会发生移动,HI的浓度变为原平衡的$\frac{1}{2}$.
解答 解:(1)3min到达平衡,平衡时HI浓度变化为0.5mol/L,平均速率v(HI)=$\frac{0.5mol/L}{3min}$=0.167 mol/(L•min),故答案为:0.167 mol/(L•min);
(2)①因为正反应是放热反应,升高温度平衡将向逆反应方向移动,所以化学平衡常数K值必定减小;HI浓度也减小,曲线c符合,故答案为:减小;c;
②若加入I2,平衡正向移动,H2浓度减小,曲线f符合,故答案为:f;
(3)因为该反应前后化学计量数相等,所以,当反应达到平衡后将反容器容积扩大一倍,平衡不会发生移动,HI的浓度变为原平衡的$\frac{1}{2}$,图象为: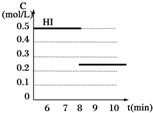 ,
,
故答案为: .
.
点评 本题考查化学平衡影响因素、反应速率计算、化学平衡图象,侧重考查学生分析能力,难度中等.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
11.下列关于浓硫酸的说法错误的是( )
| A. | 能干燥氯气 | B. | 能使蔗糖炭化 | ||
| C. | 久置后浓度变大 | D. | 加热时能与碳反应 |
12.下列有关说法正确的是( )
| A. | 普通锌锰干电池中的MnO2在工作时起催化作用 | |
| B. | 若1mol Na2O2与足量水反应产生O2,理论上转移的电子数约为2×6.02×1023 | |
| C. | 室温下,体积、pH均相同的HA和HB两种酸分别与足量的锌反应,HA放出氢气多,说明酸性:HB>HA | |
| D. | 恒温恒压密闭容器中进行的反应N2(g)+3H2(g)?2NH3(g)△H=-a kJ•mol-1,平衡时向容器中再充入一定量NH3,重新达平衡时a值不变 |
9.把ag铁、铝粉末混合物溶于足量NaOH溶液后,过滤出沉淀,经洗涤、干燥后的滤渣与足量水在高温下发生反应,充分反应后得到固体物质的质量仍为ag,则原混合物中铁的质量分数为( )
| A. | 72.4% | B. | 77.8% | C. | 70% | D. | 30% |
16.在足量纯锌和稀硫酸的混合物中,滴加几滴下列溶液,产生氢气速率会增大,但是最终产生氢气总质量不变的是( )
| A. | 硫酸铜溶液 | B. | 较浓稀硫酸 | C. | 碳酸钠溶液 | D. | 硝酸银溶液 |
10.已知:
2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1
2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H=-1452kJ•mol-1
H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1
下列说法正确的是( )
2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1
2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H=-1452kJ•mol-1
H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1
下列说法正确的是( )
| A. | 相同条件下,如果1mol H原子所具有的能量为E1,1mol H2所具有能量为E2,则2E1=E2 | |
| B. | 同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多 | |
| C. | $\frac{1}{2}$H2SO4(aq)+$\frac{1}{2}$Ba(OH)2(aq)═$\frac{1}{2}$BaSO4(s)+H2O(l)△H=-57.3 kJ•mol-1 | |
| D. | 3H2(g)+CO2(g)═CH3OH(l)+H2O(l)△H=+135.9kJ•mol-1 |