题目内容
18.晶体硅是一种重要的非金属材料,工业上用碳在高温下还原石英砂(主要成份为含铁、铝等杂质的二氧化硅)得粗硅,粗硅与氛气在450-500℃条件下反应生成四氯化硅,四氯化硅经提纯后与过量H2在1100-1200℃条件下反应制得高纯硅.以下是实验室制备SiCl4的装置示意图.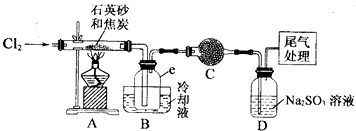
实验过程中;石英砂中的铁、铝等杂质也能转化为相应氯化物,SiCl4,A1C13,FeC13遇水均易水解,有关物质的物理常数见下表:
| 物质 | SiC14 | A1C13 | FeC13 |
| 沸点/℃ | 57.7 | - | 315 |
| 熔点/℃ | -70.0 | - | - |
| 升华温度/℃ | - | 180 | 300 |
(I)实验室制备氛气有以下五步操作,其正确操作顺序为④③⑤②①(填标号).
①向烧瓶中装入二氧化锰固体,向分液漏斗中加入浓盐酸
②检查装置的气密性
③把酒精灯放在铁架台上,根据酒精灯火焰确定铁圈高度,固定铁圈,放上石棉网
④在烧瓶上装好分液漏斗,安装好导气管
⑤将烧瓶固定在铁架台上
(2)装置A的硬质玻璃管中发生主要反应的化学方程式是2C+SiO2+2Cl2$\frac{\underline{\;高温\;}}{\;}$SiCl4+2CO↑;,置A.B间导管短且粗的原因是防止生成物中的AlCl3、FeCl3等杂质凝结成固体堵塞导管,实验中尾气处理的方法是连接一个加热的装有CuO粉末的反应管.
(3)装置B中e瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氛化硅.在精馏过程中,不可能用到的仪器有CD(填正确答案标号).
A.圆底烧瓶 B.温度计 C.吸滤瓶 D球形冷凝管 E.接收器
(4)装置D中的Na2SO3的作用主要是吸收未反应完的Cl2请设计一个实验,证明装置D中的Na2SO3已被氧化(简述实验步骤):取少量溶液置于洁净的试管中,向其中滴加稀盐酸至不再产生气体;再向其中滴入氯化钡溶液,若产生白色沉淀,证明亚硫酸钠被氧化.
(5)SiCl4极易水解,其完全水解的产物为H4SiO4(或H2SiO3)和HCl;H2还原SiCl4制得高纯硅的过程中若混入O2,可能引起的后果是可能引起爆炸、硅被氧化得不到高纯硅.
分析 A中发生二氧化硅和碳和氯气反应生成四氯化硅,由信息可知,四氯化硅的沸点低,则B装置冷却可收集四氯化硅,C可防止防止B右端的水蒸气进入B与四氯化硅反应,造成产物不纯,最后D处理含氯气的尾气.
(1)在实验室中由浓盐酸和二氧化锰制备氯气,按照先下后上,先左后右的原则搭建实验装置,因制备气体,所以需检查装置的气密性,然后装入药品进行制备;
(2)在D装置中二氧化硅和碳和氯气反应生成四氯化硅和一氧化碳;产物中有AlCl3、FeCl3防止凝结成固体堵塞导管,尾气主要为一氧化碳,可用氧化铜检验;
(3)根据精馏(类似多次蒸馏)原理,精馏过程中不可能用到吸滤瓶和球形冷凝器管;
(4)氯气有强氧化性,亚硫酸根离子有还原性,所以氯气和亚硫酸根离子能发生氧化还原反应生成硫酸根离子、氯离子和氢离子;如果亚硫酸钠被氧化会生成硫酸钠,根据硫酸根离子的检验方法检验即可;
(5)SiCl4极易水解,生成原硅酸和氯化氢,氢气和氧气混合在加热的条件下易发生爆炸,硅易与氧气反应生成氧化硅.
解答 解:(1)加热条件下,实验室用浓盐酸和二氧化锰制取氯气,二者反应生成氯化锰、氯气和水,方程式为:MnO2+4HCl$\frac{\underline{\;加热\;}}{\;}$MnCl2+Cl2↑+2H2O,搭建实验装置应先下后上,先左后右的原则,所以先在烧瓶上装好分液漏斗,安装好导气管,把酒精灯放在铁架台上,根据酒精灯火焰确定铁圈高度,固定铁圈,放上石棉,将烧瓶固定在铁架台上,因制备气体,所以需检查装置的气密性,然后装入药品,所以检查装置的气密性,向烧瓶中装入二氧化锰固体,向分液漏斗中加入浓盐酸,即正确操作顺序为④③⑤②①,
故答案为:③⑤②①;
(2)在A装置中二氧化硅和碳和氯气反应生成四氯化硅和一氧化碳,反应为:2C+SiO2+2Cl2$\frac{\underline{\;高温\;}}{\;}$SiCl4+2CO↑,生成物中有AlCl3、FeCl3等杂质,凝结成固体堵塞导管,所以装置A.B间导管短且粗,尾气主要为一氧化碳,氧化铜和一氧化碳在加热的条件下反应生成二氧化碳和铜,铜为红色固体,所以可用氧化铜验尾气,
故答案为:2C+SiO2+2Cl2$\frac{\underline{\;高温\;}}{\;}$SiCl4+2CO↑;防止生成物中的AlCl3、FeCl3等杂质凝结成固体堵塞导管;连接一个加热的装有CuO粉末的反应管;
(3)吸滤瓶用于减压过滤装置中,与精馏(类似多次蒸馏)无关,球形冷凝管含有球形部分区域,不适合精馏,蒸馏需圆底烧瓶盛放待蒸馏的液体,需温度计测量蒸气的温度,需接收器接受馏分,
故答案为:CD;
(4)亚硫酸钠被氧化生成硫酸钠,只有验证硫酸根离子的存在就可证明亚硫酸钠已经被氧化,检验硫酸根离子的存在选用试剂稀盐酸和氯化钡溶液,实验设计如下:取少量溶液置于洁净试管中,向其中加入稀盐酸至不再产生气体,再向其中滴入氯化钡溶液,若产生白色沉淀,证明Na2SO3已被氧化,
故答案为:取少量溶液置于洁净的试管中,向其中滴加稀盐酸至不再产生气体;再向其中滴入氯化钡溶液,若产生白色沉淀,证明亚硫酸钠被氧化;
(5)SiCl4水解反应方程式为:SiCl4+4H2O═H4SiO4↓+4HCl↑,生成原硅酸氯化氢,原硅酸易失去水生成硅酸H2SiO3,H2还原SiCl4制得高纯硅的过程中若混入O2,可能引起爆炸,硅被氧化得不到高纯硅,
故答案为:H4SiO4(或H2SiO3)和HCl;可能引起爆炸、硅被氧化得不到高纯硅.
点评 本题考查制备实验方案的设计,综合了氯气的制法、硅的提纯、SiCl4的制备等实验知识,注意把握制备原理及实验流程中的反应、物质的性质等为解答的关键,侧重分析与实验能力的综合考查,题目难度中等.

| A. | 密度之比为7:11 | B. | 体积之比为11:7 | ||
| C. | 物质的量之比为7:11 | D. | 质量之比为11:7 |
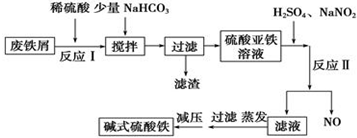
部分阳离子以氢氧化物形式沉淀时溶液的pH如表所示:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
(1)加入少量NaHCO3的目的是调节溶液的pH,除去Al3+,①pH的范围4.4-7.5
②写出可能发生的离子方程式:Al3++3HCO3-=Al(OH)3↓+3CO2↑
(2)在实际生产中,反应Ⅱ中常同时通入O2,以减少NaNO2的用量,O2与NaNO2在反应中均作氧化剂;若参与反应的O2有11.2L(标准状况),则相当于节约NaNO2的物质的量为2mol
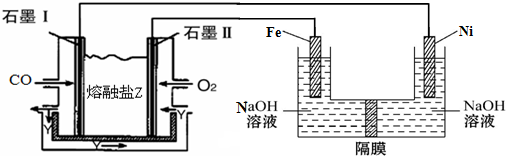
(3)碱式硫酸铁溶于水后产生的Fe(OH)2+可部分水解生成Fe2(OH)42+,该水解反应的离子方程式为2Fe(OH)2++2H2O?Fe2(OH)42++2H+
(4)现以CO、O2、熔融盐Na2CO3组成的燃料电池,采用电解法制备高铁酸盐Na2FeO4的装置如图所示,其中Y为CO2.
写出石墨I电极上发生反应的电极反应式CO+CO32--2e-=2CO2
写出电解池中生成FeO42-的电极反应式为Fe-6e-+8OH-=FeO42-+4H2O.

 苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一.下面是它的一种实验室合成路线:
苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一.下面是它的一种实验室合成路线: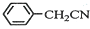 +H2O+H2SO4$\stackrel{100~130℃}{→}$
+H2O+H2SO4$\stackrel{100~130℃}{→}$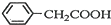 +NH4HSO4
+NH4HSO4 +Cu(OH)2→(
+Cu(OH)2→(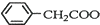 )2Cu+H2O
)2Cu+H2O 二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒剂,回答下列问题:
二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒剂,回答下列问题: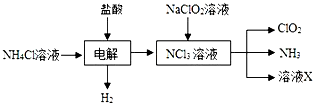
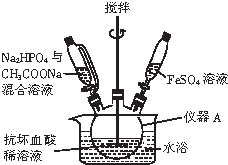 磷酸亚铁晶体[Fe3(PO4)2•8H2O]是蓝白色单斜晶体,溶于稀强酸,不溶于水、醋酸、醇,主要用于制作磷酸铁锉电池.实验室制备磷酸亚铁晶体的装置、反应原理和实验步骤如下:
磷酸亚铁晶体[Fe3(PO4)2•8H2O]是蓝白色单斜晶体,溶于稀强酸,不溶于水、醋酸、醇,主要用于制作磷酸铁锉电池.实验室制备磷酸亚铁晶体的装置、反应原理和实验步骤如下: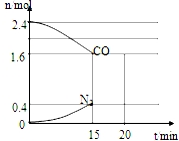 CO和NO是汽车尾气的主要污染物.消除汽车尾气的反应式之一为:2NO(g)+2CO(g)?N2(g)+2CO2(g).请回答下列问题:
CO和NO是汽车尾气的主要污染物.消除汽车尾气的反应式之一为:2NO(g)+2CO(g)?N2(g)+2CO2(g).请回答下列问题: