题目内容
6.恒温条件下将气体A、B置于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)?2C(g)+2D(g),反应进行到10s末,达到平衡,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol,则:(1)用C表示10s 内正反应的化学反应速率为0.04mol•L-1•s-1;
(2)反应前A的物质的量浓度是1.5mol•L-1;
(3)平衡时A的转化率为40%;
(4)能说明该反应达到平衡状态的是BD;
A.消耗3mol A同时生成2mol C.
B.反应体系中各物质的百分含量不变
C.混合气体平均相对分子质量不变
D.2V正(A)=3V逆(C).
分析 恒温条件下将气体A、B置于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)?2C(g)+2D(g),反应进行到10s末,达到平衡,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol,则
3A(g)+B(g)?2C(g)+2D(g),
起始 0 0
转化 1.2mol 0.4mol 0.8 mol 0.8 mol
平衡 1.8mol 0.6mol 0.8 mol 0.8 mol
所以A反应前的物质的量为1.2mol+1.8mol=3.0mol,以此解答该题.
解答 解:恒温条件下将气体A、B置于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)?2C(g)+2D(g),反应进行到10s末,达到平衡,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol,则
3A(g)+B(g)?2C(g)+2D(g),
起始 0 0
转化 1.2mol 0.4mol 0.8 mol 0.8 mol
平衡 1.8mol 0.6mol 0.8 mol 0.8 mol
所以A反应前的物质的量为1.2mol+1.8mol=3.0mol,
(1)反应前C的物质的量为0.反应后C的物质的量为0.8mol,所以C的物质的量的变化量为0.8mol,
v(C)=$\frac{△C}{△t}=\frac{△n}{V△t}=\frac{0.8mol}{2L\;.10s}$=0.04mol•L-1•s-1
故答案为:0.04mol•L-1•s-1;
(2)cA)=$\frac{n}{V}=\frac{3.0mol}{2L}$=1.5 mol•L-1;
故答案为:1.5 mol•L-1;
(3)平衡时A的转化率为$\frac{1.2}{3}×100%$=40%,故答案为:40%;
(4)A.反应速率之比等于化学计量数之比,无论是否平衡都存在消耗3mol A同时生成2mol C,不能说明达到平衡状态,故A错误;
B.反应体系中各物质的百分含量不变,可说明达到平衡状态,故B正确;
C.由于反应前后气体的质量、物质的量都不变,则混合气体平均相对分子质量不变,不能说明达到平衡状态,故C错误;
D.2V正(A)=3V逆(C),可说明正逆反应速率相等,达到平衡状态,故D正确.
故答案为:BD.
点评 本题考查化学平衡的计算,为高频考点,侧重于学生的分析、计算能力的考查,题目涉及化学反应速率的定量表示方法,知道“在温度、体积不变的密闭容器中,反应前后气体的物质的量之比等于压强之比”,是解题的关键,难度不大.

 阅读快车系列答案
阅读快车系列答案| A. | 铝热反应是炼铁最常用的方法 | |
| B. | 硅是现代光学及光纤制品的基本原料 | |
| C. | 采用“静电除尘”“燃煤固硫”“汽车尾气催化净化”等方法可提高空气质量 | |
| D. | 袋装食品常用生石灰包作为食品的抗氧化剂 |
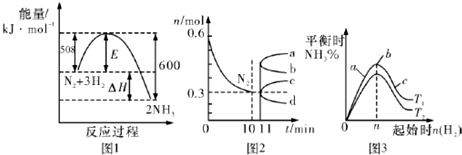
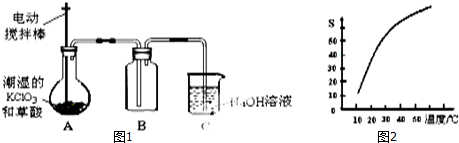
| A. | 升高温度,该反应的平衡常数增大 | |
| B. | 由图2信息,10 min内该反应的平均速率v(H2)=0.09 mol•L-1•min-1 | |
| C. | 由图2信息,从11 min起其它条件不变,压缩容器的体积,则n(N2)的变化曲线为d | |
| D. | 图3中温度T1<T2,a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是b点 |
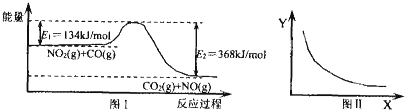
下列有关说法正确的是( )
| A. | 该反应的焓变△H=+234 kJ•mol-1 | |
| B. | 若X表示温度,则Y表示的可能是CO2的物质的量浓度 | |
| C. | 若X表示CO的起始浓度,则Y表示的可能是NO2的转化率 | |
| D. | 若X表示反应时间,则Y表示的可能是混合气体的密度 |
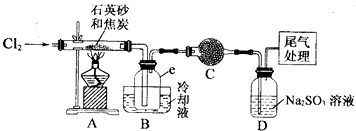
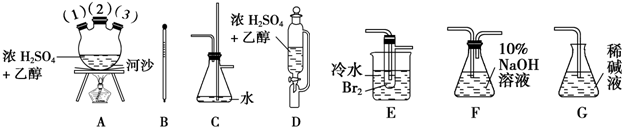
实验过程中;石英砂中的铁、铝等杂质也能转化为相应氯化物,SiCl4,A1C13,FeC13遇水均易水解,有关物质的物理常数见下表:
| 物质 | SiC14 | A1C13 | FeC13 |
| 沸点/℃ | 57.7 | - | 315 |
| 熔点/℃ | -70.0 | - | - |
| 升华温度/℃ | - | 180 | 300 |
(I)实验室制备氛气有以下五步操作,其正确操作顺序为④③⑤②①(填标号).
①向烧瓶中装入二氧化锰固体,向分液漏斗中加入浓盐酸
②检查装置的气密性
③把酒精灯放在铁架台上,根据酒精灯火焰确定铁圈高度,固定铁圈,放上石棉网
④在烧瓶上装好分液漏斗,安装好导气管
⑤将烧瓶固定在铁架台上
(2)装置A的硬质玻璃管中发生主要反应的化学方程式是2C+SiO2+2Cl2$\frac{\underline{\;高温\;}}{\;}$SiCl4+2CO↑;,置A.B间导管短且粗的原因是防止生成物中的AlCl3、FeCl3等杂质凝结成固体堵塞导管,实验中尾气处理的方法是连接一个加热的装有CuO粉末的反应管.
(3)装置B中e瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氛化硅.在精馏过程中,不可能用到的仪器有CD(填正确答案标号).
A.圆底烧瓶 B.温度计 C.吸滤瓶 D球形冷凝管 E.接收器
(4)装置D中的Na2SO3的作用主要是吸收未反应完的Cl2请设计一个实验,证明装置D中的Na2SO3已被氧化(简述实验步骤):取少量溶液置于洁净的试管中,向其中滴加稀盐酸至不再产生气体;再向其中滴入氯化钡溶液,若产生白色沉淀,证明亚硫酸钠被氧化.
(5)SiCl4极易水解,其完全水解的产物为H4SiO4(或H2SiO3)和HCl;H2还原SiCl4制得高纯硅的过程中若混入O2,可能引起的后果是可能引起爆炸、硅被氧化得不到高纯硅.
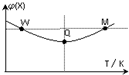 在2L恒容密闭容器中充入2mol X和1mol Y发生反应:2X(g)+Y(g)?3Z(g)△H<0,反应过程持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示.下列推断正确的是( )
在2L恒容密闭容器中充入2mol X和1mol Y发生反应:2X(g)+Y(g)?3Z(g)△H<0,反应过程持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示.下列推断正确的是( )| A. | 升高温度,平衡常数增大 | |
| B. | W点X的正反应速率小于M点X的正反应速率 | |
| C. | Q点时,Y的转化率最小 | |
| D. | 平衡时充入Z,达到新平衡时Z的体积分数比原平衡时大 |