题目内容
9.下列各电离方程式中,书写正确的是( )| A. | H2S?2H++S2- | B. | KHSO4?K++H++SO42- | ||
| C. | Al(OH)3?Al3++3OH- | D. | NaH2PO4═Na++H2PO4- |
分析 强电解质完全电离,用等号;弱电解质部分电离,用可逆号,多元弱酸的酸式根离子不能拆,据此解答.
解答 解:A.硫化氢为多元弱酸分步电离,以第一步为主:H2S?H++HS-,故A错误;
B.硫酸氢钾为强电解质,完全电离,应用等号:KHSO4=K++H++SO42-,故B错误;
C.氢氧化铝为弱电解质,且为两性氢氧化物,存在两种电离方式:AlO2-+H++H2O?Al(OH)3?Al3++3OH-,Al(OH)3?Al3++3OH-为碱式电离,故C正确;
D.磷酸二氢钠为强电解质,完全电离出钠离子和磷酸二氢根离子,电离方程式:NaH2PO4═Na++H2PO4-,故C正确;
故选:CD.
点评 本题考查了电解质电离方程式的书写,明确电解质强弱及电离方式是解题关键,注意氢氧化铝为两性氢氧化物存在酸式和碱式两种电离方式,题目难度不大.

练习册系列答案
相关题目
19.某反应可用下式表示:xR2++yH++O2═mR3++nH2O. 则m的值为( )
| A. | 2x | B. | 4 | C. | $\frac{y}{2}$ | D. | 7 |
20.下列各组元素的性质递变情况错误的是( )
| A. | N、O、F原子最外层电子数依次增加 | |
| B. | N、O、F原子半径依次增大 | |
| C. | Na、Mg、Al元素最高正化合价依次升高 | |
| D. | Li、Na、K的金属性依次增强 |
17.既可以通过单质与单质化合,也可以通过溶液中的复分解反应来制得的化合物是( )
| A. | Na2O | B. | Na2O2 | C. | FeCl2 | D. | FeS |
4.在加热条件下,用普通铁粉和水蒸气反应可得到铁的氧化物,该氧化物是( )
| A. | FeO | B. | Fe3O4 | C. | Fe2O3 | D. | CuO |
14.某溶液中含有下列离子Na+、Fe3+、Cl-、Fe2+、Al3+,向其中先加入足量的NaOH溶液,然后微热并搅拌,再加入足量的稀盐酸原溶液中离子基本不变的为( )
| A. | Al3+ | B. | Fe3+ | C. | Cl- | D. | Fe2+ | ||||
| E. | Na+ |
1.将下列四种铁的化合物溶于稀盐酸,滴加硫氰化钾溶液没有颜色变化,再加入氯水即呈红色的是( )
| A. | FeS | B. | Fe2O3 | C. | FeCl3 | D. | Fe2(SO)4 |
18.铝空气海水电池:以铝板为负极,铂网为正极,海水为电解质溶液,空气中的氧气与铝反应产生电流.电池总反应为4Al+3O2+6H2O═4Al(OH)3
正极电极反应式:O2+2H2O+4e-=4OH-.
正极电极反应式:O2+2H2O+4e-=4OH-.
19.下列制备和收集气体的实验装置合理的是( )
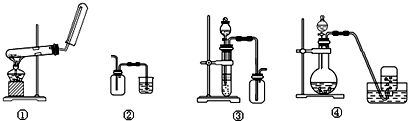

| A. | 装置①:用氯化铵和氢氧化钙制NH3 | B. | 装置②:收集NO气体 | ||
| C. | 装置③:用锌粒和稀硫酸制H2 | D. | 装置④:用双氧水和二氧化锰制O2 |