题目内容
20.下列各组元素的性质递变情况错误的是( )| A. | N、O、F原子最外层电子数依次增加 | |
| B. | N、O、F原子半径依次增大 | |
| C. | Na、Mg、Al元素最高正化合价依次升高 | |
| D. | Li、Na、K的金属性依次增强 |
分析 A.同周期元素的原子,从左到右,最外层电子数依次增多;
B.同周期元素的原子,从左到右,原子半径依次减小;
C.元素最高正价=最外层电子数;
D.同一主族元素,从上到下,金属性依次增强.
解答 A.N、O、F原子最外层电子数依次为5、6、7,逐渐增多,故A正确;
B.N、O、F是同周期元素的原子,从左到右,原子半径依次减小,故B错误;
C.Na、Mg、Al元素最高正化合价依次为+1、+2、+3,依次升高,故C正确;
D.Li、Na、K是同主族元素,从上到下的金属性依次增强,故D正确.
故选B.
点评 本题考查了元素周期表中同周期、同主族元素原子的结构、性质变化规律及应用,熟悉元素周期律是解答本题的关键,难度不大.

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目
11.能说明苯分子中的苯环为平面正六边形结构,碳碳键不是单、双键交替排列的事实是( )
| A. | 苯的一元取代物没有同分异构体 | B. | 苯的邻位二元取代物只有一种 | ||
| C. | 苯的间位二元取代物只有一种 | D. | 苯的对位二元取代物只有一种 |
8.鉴别Na2SO3溶液和稀H2SO4.请按要求完成表:
说明:第3步不能使用其他任何仪器(包括胶头滴管)和试剂.
| 步骤 | 操作 | 现象及结论 |
| 1 | 用甲、乙两支试管分别取两种溶液各少许. | |
| 2 | 用胶头滴管向甲试管中逐滴滴加BaCl2溶液至过量. | |
| 3 | 静置,将甲中上层清液注入乙中 | 若产生白色沉淀,则甲是Na2SO3溶液,乙是稀H2SO4. 若乙试管中沉淀溶解且放出有刺激性气味的气体,则甲是稀H2SO4,乙是Na2SO3溶液. |
15.能用H++OH-═H2O来表示的化学反应是( )
| A. | 氢氧化钡溶液与H2SO4溶液反应 | B. | 氢氧化钡溶液与HNO3溶液反应 | ||
| C. | KOH溶液和醋酸溶液反应 | D. | 氢氧化钠溶液与NaHCO3溶液反应 |
5.小李为了鉴别新买来的饮料不是牛奶而是豆浆,最好选用( )
| A. | 溴水 | B. | 氯水 | C. | 碘酒 | D. | 酒精 |
12.下列能量转化过程中有化学能变化的是( )
| A. | 氯化铵热分解反应 | B. | 氮气和氢气化合生成氨的反应 | ||
| C. | 碘升华 | D. | 绿色植物的光合作用生成淀粉 |
9.下列各电离方程式中,书写正确的是( )
| A. | H2S?2H++S2- | B. | KHSO4?K++H++SO42- | ||
| C. | Al(OH)3?Al3++3OH- | D. | NaH2PO4═Na++H2PO4- |
10.0.5L 1mol•L-1 FeCl3溶液与1L 1mol•L-1 KCl溶液中的Cl-的物质的量浓度之比( )
| A. | 3:2 | B. | 2:3 | C. | 3:1 | D. | 1:3 |
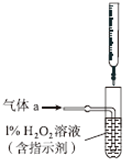 硫酸工业产生的废气(主要成分:SO2、O2、N2、CO2等)排放到空气中会污染环境.某化学兴趣小组对废气的组成进行探究,请回答下列问题:
硫酸工业产生的废气(主要成分:SO2、O2、N2、CO2等)排放到空气中会污染环境.某化学兴趣小组对废气的组成进行探究,请回答下列问题: