题目内容
C、N、S都是重要的非金属元素.下列说法正确的是( )
| A、三者对应的氧化物均为酸性氧化物 |
| B、三者的单质直接与氧气反应都能生成两种以上氧化物 |
| C、同温度、同浓度的Na2CO3、NaNO3、Na2SO3溶液的pH:NaNO3<Na2SO3<Na2CO3 |
| D、CO2、NO2、SO2都能与H2O反应,其反应原理相同 |
考点:酸、碱、盐、氧化物的概念及其相互联系,化学基本反应类型,盐类水解的应用
专题:元素及其化合物
分析:A.CO、NO为不成盐氧化物;
B.氮气和氧气反应生成NO,硫在氧气中燃烧生成二氧化硫;
C.根据酸性的强弱关系:HNO3>H2SO3>H2CO3来判断;
D.二氧化氮和水反应属于氧化还原反应.
B.氮气和氧气反应生成NO,硫在氧气中燃烧生成二氧化硫;
C.根据酸性的强弱关系:HNO3>H2SO3>H2CO3来判断;
D.二氧化氮和水反应属于氧化还原反应.
解答:
解:A.CO、NO为不成盐氧化物,所以三者对应的氧化物不均为酸性氧化物,故A错误;
B.氮气和氧气直接反应生成NO,NO继续与氧气反应生成二氧化氮,S在氧气中燃烧只能生成二氧化硫,故B错误;
C.酸性的强弱关系:HNO3>H2SO3>H2CO3且HNO3为强酸,故NaNO3显中性,而H2SO3、H2CO3均为弱酸且酸性H2SO3>H2CO3,故Na2CO3、Na2SO3显碱性且碱性Na2CO3>Na2SO3,故pH的大小关系为:NaNO3<Na2SO3<Na2CO3;故C正确;
D.CO2+H2O=H2CO3、SO2+H2O=H2SO3中没有电子转移属于非氧化还原反应,3NO2+H2O=2HNO3+NO中有电子转移属于氧化还原反应,故D错误;
故选C.
B.氮气和氧气直接反应生成NO,NO继续与氧气反应生成二氧化氮,S在氧气中燃烧只能生成二氧化硫,故B错误;
C.酸性的强弱关系:HNO3>H2SO3>H2CO3且HNO3为强酸,故NaNO3显中性,而H2SO3、H2CO3均为弱酸且酸性H2SO3>H2CO3,故Na2CO3、Na2SO3显碱性且碱性Na2CO3>Na2SO3,故pH的大小关系为:NaNO3<Na2SO3<Na2CO3;故C正确;
D.CO2+H2O=H2CO3、SO2+H2O=H2SO3中没有电子转移属于非氧化还原反应,3NO2+H2O=2HNO3+NO中有电子转移属于氧化还原反应,故D错误;
故选C.
点评:本题考查非金属元素及其化合物的性质,涉及尾气处理、氧化还原反应的判断等知识点,熟练掌握C、N、S、Cl元素及其化合物性质并灵活运用,为高考高频点,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
甲、乙两物质的溶解度曲线如图所示,下列说法正确的是( )
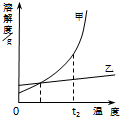

| A、t1℃时,物质的量浓度:甲=乙 |
| B、温度变化相同时,溶解度数值的变化量:甲>乙 |
| C、t2℃时,饱和溶液中溶质的质量分数:甲=乙 |
| D、相同质量的饱和溶液由t2℃降到t1℃时,析出的固体:甲<乙 |
下列说法正确的是( )
| A、氨水能导电,所以氨气是电解质 |
| B、SO2的水溶液能导电,但是SO2是非电解质 |
| C、水溶液中NaHSO4=Na++HSO4- |
| D、FeCl3溶液为酸性,因为Fe3++3H2O=Fe(OH)3+3H+ |
常温下,甲组中的某种物质能与乙组中的所有物质发生反应,甲组中的该物质是( )
| 甲组 | ①Al(OH)3 ②SiO2 ③FeCl3溶液 ④SO2 |
| 乙组 | a.NaOH溶液 b.浓HNO3 c.氨水 d.氯水 e.H2O2溶液 |
| A、① | B、② | C、③ | D、④ |
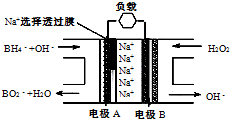 直接NaBH4/H2O2燃料电池(DBFC)的结构如右图,有关该电池的说法正确的是( )
直接NaBH4/H2O2燃料电池(DBFC)的结构如右图,有关该电池的说法正确的是( )| A、电极B材料中包含MnO2层,MnO2可起催化作用 |
| B、电池负极区的电极反应为:BH4-+8OH-+8e-=BO2-+6H2O |
| C、放电过程中,Na+ 从正极区向负极区迁移 |
| D、在电池反应中,每消耗1L 6 mol/LH2O2溶液,理论上流过电路中的电子为6NA个 |
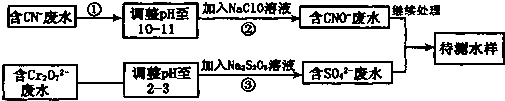
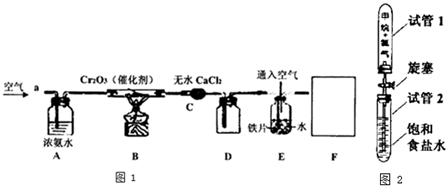
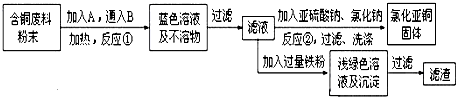
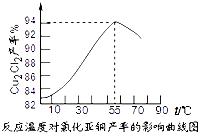 氯化亚铜(Cu2Cl2)是一种重要的化工产品,常用作有机合成催化剂.已知:
氯化亚铜(Cu2Cl2)是一种重要的化工产品,常用作有机合成催化剂.已知: