题目内容
下列说法正确的是( )
| A、氨水能导电,所以氨气是电解质 |
| B、SO2的水溶液能导电,但是SO2是非电解质 |
| C、水溶液中NaHSO4=Na++HSO4- |
| D、FeCl3溶液为酸性,因为Fe3++3H2O=Fe(OH)3+3H+ |
考点:电离方程式的书写,离子方程式的书写,电解质与非电解质
专题:
分析:A.电解质必须是化合物;
B.二氧化硫与水反应生成亚硫酸,本身不能电离;
C.硫酸氢钠为强电解质在水中完全电离出钠离子、氢离子和硫酸根离子;
D.水解是少量的,应可逆符号.
B.二氧化硫与水反应生成亚硫酸,本身不能电离;
C.硫酸氢钠为强电解质在水中完全电离出钠离子、氢离子和硫酸根离子;
D.水解是少量的,应可逆符号.
解答:
解:A.氨水是混合物,不是电解质,故A错误;
B.二氧化硫与水反应生成亚硫酸,亚硫酸是电解质,二氧化硫本身不能电离,属于非电解质,故B正确;
C.硫酸氢钠为强电解质在水中完全电离,电离方程式为:NaHSO4=Na++H++SO42-,故C错误;
D.三价铁离子为弱碱阳离子,水解的离子方程式为:Fe3++3H2O?Fe(OH)3+3H+,故D错误;
故选:B.
B.二氧化硫与水反应生成亚硫酸,亚硫酸是电解质,二氧化硫本身不能电离,属于非电解质,故B正确;
C.硫酸氢钠为强电解质在水中完全电离,电离方程式为:NaHSO4=Na++H++SO42-,故C错误;
D.三价铁离子为弱碱阳离子,水解的离子方程式为:Fe3++3H2O?Fe(OH)3+3H+,故D错误;
故选:B.
点评:本题考查了电解质的判断及电离方程式的书写、盐类水解离子方程式的书写,明确物质的性质是解题关键,注意电解质必须是本身能够电离的化合物,单质和混合物既不是电解质又不是非电解质.

练习册系列答案
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案
相关题目
第ⅠA族元素具有相似的化学性质,是由于它们的原子具有相同的( )
| A、原子半径 | B、电子层数 |
| C、核外电子数 | D、最外层电子数 |
下列各种溶液中通入足量的SO2后,既无沉淀又无气体产生的是( )
①NaClO ②C6H5ONa ③Na2S ④BaCl2 ⑤Ba(OH)2 ⑥H2O2.
①NaClO ②C6H5ONa ③Na2S ④BaCl2 ⑤Ba(OH)2 ⑥H2O2.
| A、①④⑥ | B、①②③ |
| C、④⑤⑥ | D、①④⑤⑥ |
同温同压下,下列有关等体积的二氧化碳和氢气的比较中,正确的是( )
| A、物质的量比为1:1 |
| B、密度比为11:1 |
| C、质量比为1:22 |
| D、质子数比为3:2 |
下列有机反应方程式书写正确的是( )
A、CH3COOH+CH3CH2OH
| |||
B、CH4+Cl2
| |||
C、2CH3CH2OH+O2
| |||
D、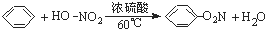 |
下列常见物质的分类不正确的是( )
| A、CO2是酸性氧化物 |
| B、氨水是混合物 |
| C、冰醋酸是电解质 |
| D、纯碱是碱 |
C、N、S都是重要的非金属元素.下列说法正确的是( )
| A、三者对应的氧化物均为酸性氧化物 |
| B、三者的单质直接与氧气反应都能生成两种以上氧化物 |
| C、同温度、同浓度的Na2CO3、NaNO3、Na2SO3溶液的pH:NaNO3<Na2SO3<Na2CO3 |
| D、CO2、NO2、SO2都能与H2O反应,其反应原理相同 |
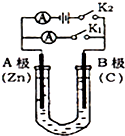 如图所示,U形管内盛有100mL的溶液,按要求回答下列问题:
如图所示,U形管内盛有100mL的溶液,按要求回答下列问题: