题目内容
Ⅰ、某学习小组探究氨的还原性及检验产物的性质,按图1装置进行实验(夹持仪器已略去).将B处的Cr2O3加热至红热,再鼓入空气.
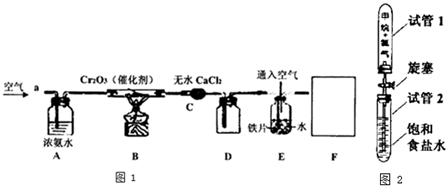
已知:无水CaCl2可吸收氨气和水回答下列问题:
(1)B中发生反应的化学方程式是 .
(2)证明氨气发生了催化氧化的现象是:D广口瓶中有 产生.
(3)E中少量铁片以 (写离子符号)离子存在.
(4)若向E中缓缓通入空气(空气中氧气占l/4体积)的目的是使NO充分转化为 NO3-,假设产生NO的速率是V(L/s),则通入空气的速率是 (L/s).
(5)整套装置F址添加一种装置后,此实验设计才较完善,请补画出F装置图(要求 注明装置中所加试剂名称).
(6)氨作为燃料电池的燃气,电池的总反应为4NH3+3O2=2N2+6H2O,该燃料电池以KOH溶液为电解质溶液,负极反应式为
Ⅱ探究甲烷与氯气反应
某同学设计如图2所示装置进行探究.反应结束后,打开旋塞.
(7)能证明甲烷与氯气确实发生了反应的现象是
(8)甲烷与氧气完全反应,当产生1.8g水蒸气时,放热a kJ,写出甲烷燃烧的热化学方程式 .

已知:无水CaCl2可吸收氨气和水回答下列问题:
(1)B中发生反应的化学方程式是
(2)证明氨气发生了催化氧化的现象是:D广口瓶中有
(3)E中少量铁片以
(4)若向E中缓缓通入空气(空气中氧气占l/4体积)的目的是使NO充分转化为 NO3-,假设产生NO的速率是V(L/s),则通入空气的速率是
(5)整套装置F址添加一种装置后,此实验设计才较完善,请补画出F装置图(要求 注明装置中所加试剂名称).
(6)氨作为燃料电池的燃气,电池的总反应为4NH3+3O2=2N2+6H2O,该燃料电池以KOH溶液为电解质溶液,负极反应式为
Ⅱ探究甲烷与氯气反应
某同学设计如图2所示装置进行探究.反应结束后,打开旋塞.
(7)能证明甲烷与氯气确实发生了反应的现象是
(8)甲烷与氧气完全反应,当产生1.8g水蒸气时,放热a kJ,写出甲烷燃烧的热化学方程式
考点:性质实验方案的设计
专题:
分析:(1)氨的催化氧化产物是一氧化氮和水,据此来书写反应方程式;
(2)氨气发生了催化氧化的产物一氧化氮极易和氧气化合为二氧化氮;
(3)二氧化氮和水反应会获得硝酸,少量铁和硝酸反应生成硝酸铁、一氧化氮和水;
(4)根据反应2NO+O2=2NO2和3NO2+H2O=2HNO3+NO推出反应4NO+3O2+2H2O=4HNO3,可判断通入空气的速率;
(5)应该在装置F中用碱性溶液来吸收生成的氮的氧化物;
(6)燃料电池中,负极是燃料发生失电子的氧化反应;
(7)甲烷与氯气反应生成HCl气体和氯代烷,HCl溶于水使NaCl的溶解平衡左移,析出氯化钠固体;
(8)根据一定质量的甲烷燃烧放出的热量可计算反应热,进而可写出热化学方程式.
(2)氨气发生了催化氧化的产物一氧化氮极易和氧气化合为二氧化氮;
(3)二氧化氮和水反应会获得硝酸,少量铁和硝酸反应生成硝酸铁、一氧化氮和水;
(4)根据反应2NO+O2=2NO2和3NO2+H2O=2HNO3+NO推出反应4NO+3O2+2H2O=4HNO3,可判断通入空气的速率;
(5)应该在装置F中用碱性溶液来吸收生成的氮的氧化物;
(6)燃料电池中,负极是燃料发生失电子的氧化反应;
(7)甲烷与氯气反应生成HCl气体和氯代烷,HCl溶于水使NaCl的溶解平衡左移,析出氯化钠固体;
(8)根据一定质量的甲烷燃烧放出的热量可计算反应热,进而可写出热化学方程式.
解答:
解:(1)B中发生的反应是氨的催化氧化反应,原理方程式为:4NH3+5O2
4NO+6H2O,
故答案为:4NH3+5O2
4NO+6H2O;
(2)氨气发生了催化氧化的产物一氧化氮极易和氧气化合为二氧化氮,即2NO+O2=2NO2,所以D中广口瓶中有红棕色气体产生,
故答案为:红棕色气体;
(3)在E中,生成的二氧化氮和水反应会生成硝酸,金属铁和硝酸反应方程式为Fe+4HNO3HNO3=Fe(NO3)3+NO↑+2H2O,故铁以Fe3+方式存在,
故答案为:Fe3+;
(4)根据反应2NO+O2=2NO2和3NO2+H2O=2HNO3+NO推出反应4NO+3O2+2H2O=4HNO3,可知NO和O2的体积之比为4:3时,完全反应生成硝酸,空气中氧气占
体积,产生NO的速率是V(L/s),所以通入空气的速率是3V(L/s),
故答案为:3V;
(5)E中铁与硝酸反应生成氮的氧化物,直接排放会污染大气,需要用NaOH溶液吸收,图为 ,
,
故答案为: ;
;
(6)燃料电池中,负极是燃料发生失电子的氧化反应,所以氨作为燃料电池燃气时,负极上是氨气失电子的过程,即2NH3-6e-+6OH-=N2+6H2O,
故答案为:2NH3-6e-+6OH-=N2+6H2O;
(7)甲烷与氯气反应生成HCl气体和氯代烷,反应结束后,打开旋塞,HCl溶于水使NaCl的溶解平衡左移,析出氯化钠固体,
故答案为:有白色晶体析出;
(8)n(CH4)=
×2×
=0.05mol,放热a kJ,则1mol甲烷反应可放出20akJ热量,热化学方程式为CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-20akJ?mol-1,
故答案为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-20akJ?mol-1.
| ||
| △ |
故答案为:4NH3+5O2
| ||
| △ |
(2)氨气发生了催化氧化的产物一氧化氮极易和氧气化合为二氧化氮,即2NO+O2=2NO2,所以D中广口瓶中有红棕色气体产生,
故答案为:红棕色气体;
(3)在E中,生成的二氧化氮和水反应会生成硝酸,金属铁和硝酸反应方程式为Fe+4HNO3HNO3=Fe(NO3)3+NO↑+2H2O,故铁以Fe3+方式存在,
故答案为:Fe3+;
(4)根据反应2NO+O2=2NO2和3NO2+H2O=2HNO3+NO推出反应4NO+3O2+2H2O=4HNO3,可知NO和O2的体积之比为4:3时,完全反应生成硝酸,空气中氧气占
| 1 |
| 4 |
故答案为:3V;
(5)E中铁与硝酸反应生成氮的氧化物,直接排放会污染大气,需要用NaOH溶液吸收,图为
 ,
,故答案为:
 ;
;(6)燃料电池中,负极是燃料发生失电子的氧化反应,所以氨作为燃料电池燃气时,负极上是氨气失电子的过程,即2NH3-6e-+6OH-=N2+6H2O,
故答案为:2NH3-6e-+6OH-=N2+6H2O;
(7)甲烷与氯气反应生成HCl气体和氯代烷,反应结束后,打开旋塞,HCl溶于水使NaCl的溶解平衡左移,析出氯化钠固体,
故答案为:有白色晶体析出;
(8)n(CH4)=
| 1.8g |
| 18g/mol |
| 1 |
| 4 |
故答案为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-20akJ?mol-1.
点评:本题是一道实验探究题目,考查学生氨气的制取和性质以及探究甲烷与氯气反应,要求学生具有分析和解决问题的能力,难度不大.

练习册系列答案
相关题目
金属钠着火时,可以灭火的物质是( )
| A、湿布 |
| B、干粉灭火器(主要成分:CO2) |
| C、煤油 |
| D、沙子 |
下列有机反应方程式书写正确的是( )
A、CH3COOH+CH3CH2OH
| |||
B、CH4+Cl2
| |||
C、2CH3CH2OH+O2
| |||
D、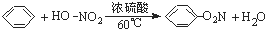 |
下列物质的分类正确的是( )
| 纯净物 | 碱性氧化物 | 酸性氧化物 | 强电解质 | |
| A | 漂白粉 | SiO2 | CO2 | AlCl3溶液 |
| B | CuSO4?5H2O | Na2O2 | N2O5 | NH4NO3 |
| C | 福尔马林 | CaO | Mn2O7 | HClO |
| D | 冰醋酸 | Na2O | SO2 | HCl |
| A、A | B、B | C、C | D、D |
C、N、S都是重要的非金属元素.下列说法正确的是( )
| A、三者对应的氧化物均为酸性氧化物 |
| B、三者的单质直接与氧气反应都能生成两种以上氧化物 |
| C、同温度、同浓度的Na2CO3、NaNO3、Na2SO3溶液的pH:NaNO3<Na2SO3<Na2CO3 |
| D、CO2、NO2、SO2都能与H2O反应,其反应原理相同 |
下列关于化学电源的说法不正确的是( )
| A、我们可以根据硫酸密度的大小来判断铅蓄电池是否需要充电 |
| B、燃料电池是利用燃料和氧化剂之间的氧化还原反应,将化学能转化为热能,然后再转化为电能的化学电源 |
| C、普通锌锰干电池中,发生氧化还原反应的物质大部分被消耗后,就不能再使用了 |
| D、由Ag2O和Zn形成的碱性银锌纽扣电池,发生电化学反应时,Zn作为负极 |
最近美国化学家借助太阳能产生的电能和热能,用空气和水作原料成功地合成了氨气.下列有关说法正确的是( )
| A、NH3是电解质 |
| B、该合成氨过程不属于氮的固定 |
| C、空气、水、太阳能均为可再生资源 |
| D、断裂N2中的N≡N键会释放出能量 |