题目内容
镁、铝合金3g与100mL稀H2SO4恰好完全反应,将反应后所得溶液蒸干,得无水硫酸盐17.4g,求算原硫酸溶液的物质的量浓度?
考点:化学方程式的有关计算
专题:
分析:镁、铝合金3g与100mL稀H2SO4恰好完全反应,将反应后所得溶液蒸干,得无水硫酸盐17.4g为硫酸镁和硫酸铝的质量,根据镁、铝质量守恒计算硫酸根的质量,再计算出硫酸根的物质的量,利用硫酸根守恒计算溶质硫酸的物质的量,以此计算硫酸的物质的量浓度.
解答:
解:17.4g为硫酸镁和硫酸铝的质量,
由于镁、铝合金3g,所以17.4g中硫酸根的质量为17.4g-3g=14.4g,
所以硫酸根的物质的量为
=0.15mol,
所以100mL稀H2SO4含有溶质硫酸的物质的量为0.15mol,
所以该稀硫酸的浓度为
=1.5mol/L,
答:原硫酸溶液的物质的量浓度为1.5 mol/L.
由于镁、铝合金3g,所以17.4g中硫酸根的质量为17.4g-3g=14.4g,
所以硫酸根的物质的量为
| 14.4g |
| 96g/mol |
所以100mL稀H2SO4含有溶质硫酸的物质的量为0.15mol,
所以该稀硫酸的浓度为
| 0.15mol |
| 0.1L |
答:原硫酸溶液的物质的量浓度为1.5 mol/L.
点评:本题考查物质的量浓度及反应的计算,为高频考点,侧重学生分析能力及计算能力的考查,本解法采取守恒法计算硫酸根的质量及硫酸的物质的量可简化计算,题目难度不大.

练习册系列答案
相关题目
下列有关有机实验的叙述正确的是( )
| A、实验室制取乙烯时,应把无水乙醇与3mol/L的H2SO4混合均匀后迅速升温至170℃ |
| B、分馏操作中,温度计水银球应放置在蒸馏烧瓶支管口附近 |
| C、除去乙酸乙酯中乙酸杂质的方法是加入饱和NaOH溶液,充分振荡、静置后,分液 |
| D、检验溴乙烷中的湨元素的方法是加入NaOH溶液共热,冷却后滴入AgNO3溶液,观察有无浅黄色沉淀生成 |
用已被部分氧化的金属屑A制备某工业常用盐C的步骤如下:将C溶于水,向其中滴入NaOH溶液,出现白色沉淀,后逐渐变为红褐色,下列判断正确的是( )
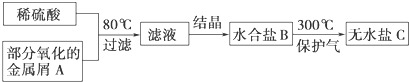

| A、过滤所得的残渣中一定没有金属A |
| B、滤液可能是CuSO4溶液或MgSO4溶液 |
| C、水合盐B可能是FeSO4?7H2O |
| D、无水盐C可能是Fe2(SO4)3 |
对蛋白质与氨基酸的下列看法,正确的是( )
| A、蛋白质都难溶于水,所以需在蛋白酶的作用下水解,方可被人体吸收 |
| B、有些易溶于水的蛋白质,被人体摄入后,不需水解成氨基酸,就可被人体吸收 |
| C、在浓硫酸钠溶液中,鸡蛋白能析出,在浓盐酸中,猪肝蛋白会发生变性 |
| D、天然蛋白质水解产物都是α氨基酸,都只含1个羧基和1个氨基 |
下列有关电解质溶液中粒子浓度关系正确的是( )
| A、pH=1的NaHSO4溶液:c(H+)=c(SO42-)+c(OH-) |
| B、含有AgCl和AgI固体的悬浊液:c(Ag+)>c(Cl-)=c(I-) |
| C、常温下物质的量浓度相等的①(NH4)2CO3、②(NH4)2SO4、③(NH4)2Fe(SO4)2三种溶液中c(NH4+):①<③<② |
| D、NaHCO3溶液中:c(Na+)>c( HCO3-)>c(OH-)>c(H+)>c(CO32-) |
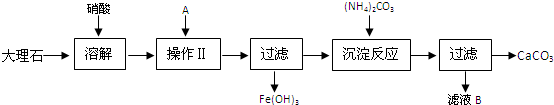
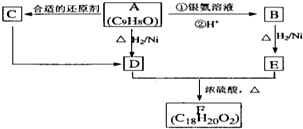
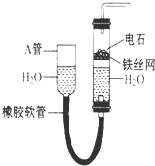 如图中的实验装置可以用于实验室制取乙炔.请填空.
如图中的实验装置可以用于实验室制取乙炔.请填空.