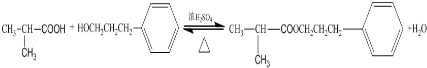
题目内容
15.乳酸亚铁晶体([CH3CH(OH)COO]2Fe•3H2O,Mr=288)是常用的补铁剂.乳酸亚铁可由乳酸与碳酸亚铁反应制得.(1)将制得的FeCO3加入乳酸溶液中,再加入过量铁粉,75℃下搅拌使之充分反应.结束后,无需过滤,除去过量铁粉的反应方程式为2CH3CH(OH)COOH+Fe→[CH3CH(OH)COO]2Fe+H2↑.
(2)从上述所得溶液中获得乳酸亚铁晶体的方法是冷却结晶、过滤、洗涤、干燥.
(3)该兴趣小组用KMnO4测定产品中亚铁含量进而计算乳酸亚铁晶体的质量分数,发现产品的质量分数总是大于100%,其原因可能是乳酸根离子中含有羟基,被酸性高锰酸钾溶液氧化.经查阅文献后,该兴趣小组改用铈(Ce)量法测定产品中Fe2+的含量.取2.880g产品配成100mL溶液,每次取20.00mL,进行必要处理,用0.1000mol•L-1Ce(SO4)2标准溶液滴定至终点,平均消耗Ce(SO4)219.7mL.滴定反应为Ce4++Fe2+═Ce3++Fe3+,则产品中乳酸亚铁晶体的质量分数为98.5%.
分析 (1)除去过量的铁粉可直接加入适量的乳酸,不会引入杂质,反应方程式为2CH3CH(OH)COOH+Fe→[CH3CH(OH)COO]2Fe+H2↑;
(2)从溶液中获得晶体,应经过冷却结晶、过滤、洗涤、干燥等操作;
(3)乳酸根中含有羟基,可以被酸性高锰酸钾溶液氧化,导致消耗高锰酸钾的增大,而计算中按亚铁离子被氧化,故计算所得乳酸亚铁的质量偏大;根据离子方程式计算20mL溶液中n(Fe2+),进而计算100mL含有n(Fe2+),再根据m=nM计算乳酸亚铁晶体的质量,进而计算产品中乳酸亚铁晶体的质量分数.
解答 解:(1)除去过量的铁粉可直接加入适量的乳酸,不会引入杂质,反应方程式为2CH3CH(OH)COOH+Fe→[CH3CH(OH)COO]2Fe+H2↑,故答案为:2CH3CH(OH)COOH+Fe→[CH3CH(OH)COO]2Fe+H2↑;
(2)在75℃下搅拌使之充分反应制得乳酸亚铁,从热溶液中获得乳酸亚铁晶体,应经过冷却结晶、过滤、洗涤、干燥等操作,
故答案为:冷却结晶;过滤;
(3)乳酸根中含有羟基,可以被酸性高锰酸钾溶液氧化,导致消耗高锰酸钾的增大,而计算中按亚铁离子被氧化,故计算所得乳酸亚铁的质量偏大,产品中乳酸亚铁的质量分数会大于100%;由:Ce4++Fe2+=Ce3++Fe3+,可知20mL溶液中n(Fe2+)=n(Ce4+)=0.1000mol/L×0.0197L=0.00197mol,故100mL含有n(Fe2+)=0.00197mol×$\frac{100mL}{20mL}$=0.00985mol,故产品中乳酸亚铁晶体的质量分数为$\frac{0.00985mol×288g/mol}{2.88g}$×100%=98.5%,
故答案为:乳酸根离子中含有羟基,被酸性高锰酸钾溶液氧化;98.5%.
点评 本题考查实验制备方案,涉及化学仪器识别、对操作的分析评价、物质分离提纯、氧化还原反应滴定应用等,明确原理是解题关键,是对学生综合能力的考查,难度中等.

 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案| A. | 20种 | B. | 29种 | C. | 30种 | D. | 48种 |
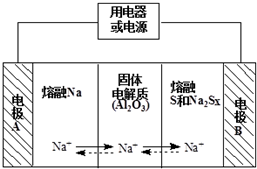 钠硫电池作为一种新型储能电池,其应用逐渐得到重视和发展.钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示,下列有关说法正确的是( )
钠硫电池作为一种新型储能电池,其应用逐渐得到重视和发展.钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示,下列有关说法正确的是( )| A. | 放电时,内电路中的Na+的从B向A移动 | |
| B. | 充电时,电极A接电源的正极 | |
| C. | 充电时,总反应为2Na+xS=Na2Sx | |
| D. | 放电时,正极的电极反应式为xS+2e-=Sx2- |
①2Fe2+(aq)+H2O2(l)+2H+(aq)═2Fe3+(aq)+2H2O(l)△H1
②2Fe3+(aq)+H2O2(l)═2Fe2+(aq)+O2(g)+2H+(aq)△H2
下列说法不正确的是( )
| A. | H2O2分解的热化学方程式为H2O2(l)═H2O(l)+$\frac{1}{2}$O2(g)△H=-98 kJ•mol-1 | |
| B. | 反应速率与Fe2+浓度有关 | |
| C. | 在H2O2分解过程中,Fe2+和Fe3+的总量保持不变 | |
| D. | △H1+△H2=196 kJ•mol-1 |
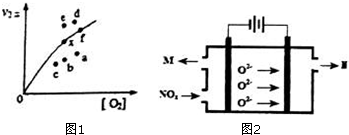 研究氮氧化物的反应机理,对于消除对环境的污染有重要意义.升高温度绝大多数的化学反应速率增大,但是2NO(g)+O2(g)?2NO2(g)的速率却随着温度的升高而减小.查阅资料知
研究氮氧化物的反应机理,对于消除对环境的污染有重要意义.升高温度绝大多数的化学反应速率增大,但是2NO(g)+O2(g)?2NO2(g)的速率却随着温度的升高而减小.查阅资料知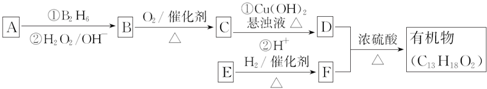
 .E发生银镜反应的离子方程式为
.E发生银镜反应的离子方程式为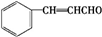 +2[Ag(NH3)2]++2OH-$\stackrel{△}{→}$
+2[Ag(NH3)2]++2OH-$\stackrel{△}{→}$ +2Ag↓+3NH3+NN4++H2O.
+2Ag↓+3NH3+NN4++H2O.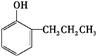 等.
等. 某化学课外活动小组为探究氮的化合物的性质,设计了如图所示实验装置,A处是气体发生装置.按如图连接好各仪器,检验装置气密性后,先将C处铂丝网加热至红热,再将A处产生的无色气体通入B装置,片刻后可观察到F中铜片表面有气泡产生.请回答下列问题:
某化学课外活动小组为探究氮的化合物的性质,设计了如图所示实验装置,A处是气体发生装置.按如图连接好各仪器,检验装置气密性后,先将C处铂丝网加热至红热,再将A处产生的无色气体通入B装置,片刻后可观察到F中铜片表面有气泡产生.请回答下列问题: