题目内容
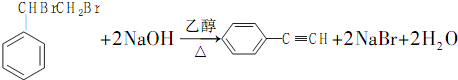
4.某烃X能使溴的CCl4溶液褪色,完全燃烧时1molX需要消耗9molO2且生成等物质的量的CO2与H2O.若其结构中含有两个-CH3,则该物质的结构(不考虑立体异构)最多有( )| A. | 6种 | B. | 5种 | C. | 4种 | D. | 7种 |
分析 1molX需要消耗9molO2且生成等物质的量的CO2与H2O,有机物中C原子个数与H原子个数的比值为1:2,即此有机物为CnH2n,且n+$\frac{2n}{4}$=9,则n=6,所以分子式为C6H12,该烃X能使溴的CCl4溶液褪色,说明含有1个碳碳双键,结构中含有2个甲基,据此判断结构简式即可.
解答 解:1molX需要消耗9molO2且生成等物质的量的CO2与H2O,有机物中C原子个数与H原子个数的比值为1:2,即此有机物为CnH2n,且n+$\frac{2n}{4}$=9,则n=6,所以分子式为C6H12,该烃X能使溴的CCl4溶液褪色,说明含有1个碳碳双键,分子结构中含有2个“-CH3”原子团,无支链,可能为:2-己烯和3-己烯;若含有1个支链甲基,则应为4-甲基-1-丁烯、3-甲基-1-丁烯、2-甲基-1-丁烯;若含有1个乙基,则为2-乙基-1-丁烯,故总共有6种,故选A.
点评 本题主要考查的是有机物同分异构体的书写,依据产生二氧化碳与水的物质的量计算C、H个数比是解决本题的关键,难度不大.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
14.己二酸是合成尼龙-66的主要原料之一.实验室合成己二酸的原理、有关数据及装置示意图如图表:
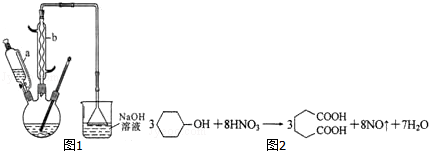
实验步骤如下:
Ⅰ.在三口烧瓶中加入16mL 50%的硝酸,再加入1~2粒沸石,滴液漏斗中盛放有5.4mL环己醇.
Ⅱ.水浴加热三口烧瓶至50℃左右,移去水浴,缓慢滴加5~6滴环己醇,摇动三口烧瓶,观察到有红棕色气体放出时再慢慢滴加剩下的环己醇,维持反应温度在60℃~65℃之间.
Ⅲ.当环己醇全部加入后,将混合物用80℃一90℃水浴加热约10min,直至无红棕色气体生成为止.
Ⅳ.趁热将反应液倒入烧杯中,放入冰水浴中冷却,析出晶体后过滤、洗涤、干燥、称重.
请回答下列问题:
(1)本实验所用50%的硝酸物质的量浓度为10.4mol/L.滴液漏斗的细支管a的作用是平衡滴液漏斗与三口烧瓶内的气压,使环己醇能够顺利流下.
(2)仪器b的名称为球形冷凝管,使用时要从下口通入冷水.
(3)NaOH溶液的作用是吸收NO2,防止污染空气,溶液上方倒扣的漏斗作用是防止液体倒吸.
(4)向三口烧瓶中滴加环己醇时,反应温度迅速上升,为使反应温度不致过高,必要时可采取的措施是将三口烧瓶置于冷水浴中.
(5)进行该实验时要控制好环己醇的滴入速率,防止反应过于剧烈,否则可能造成较严重的后果,试列举两条可能的后果:反应液暴沸冲出冷凝管;放热过多可能引起爆炸;产生的二氧化氮气体来不及被碱液吸收而外逸到空气中.
(6)为了除去可能的杂质和减少产品损失,可分别用冰水和苯洗涤晶体.

| 物质 | 密度 | 熔点 | 沸点 | 溶解性 |
| 环己醇 | 0.962g/cm3 | 25.9℃ | 160.8℃ | 20℃时水中溶解度为3.6g,可混溶于乙醇、苯 |
| 己二酸 | 1.360g/cm3 | 152℃ | 337.5℃ | 在水中的溶解度:15℃时1.44g,25℃时2.3g,易溶于乙醇、不溶于苯 |
Ⅰ.在三口烧瓶中加入16mL 50%的硝酸,再加入1~2粒沸石,滴液漏斗中盛放有5.4mL环己醇.
Ⅱ.水浴加热三口烧瓶至50℃左右,移去水浴,缓慢滴加5~6滴环己醇,摇动三口烧瓶,观察到有红棕色气体放出时再慢慢滴加剩下的环己醇,维持反应温度在60℃~65℃之间.
Ⅲ.当环己醇全部加入后,将混合物用80℃一90℃水浴加热约10min,直至无红棕色气体生成为止.
Ⅳ.趁热将反应液倒入烧杯中,放入冰水浴中冷却,析出晶体后过滤、洗涤、干燥、称重.
请回答下列问题:
(1)本实验所用50%的硝酸物质的量浓度为10.4mol/L.滴液漏斗的细支管a的作用是平衡滴液漏斗与三口烧瓶内的气压,使环己醇能够顺利流下.
(2)仪器b的名称为球形冷凝管,使用时要从下口通入冷水.
(3)NaOH溶液的作用是吸收NO2,防止污染空气,溶液上方倒扣的漏斗作用是防止液体倒吸.
(4)向三口烧瓶中滴加环己醇时,反应温度迅速上升,为使反应温度不致过高,必要时可采取的措施是将三口烧瓶置于冷水浴中.
(5)进行该实验时要控制好环己醇的滴入速率,防止反应过于剧烈,否则可能造成较严重的后果,试列举两条可能的后果:反应液暴沸冲出冷凝管;放热过多可能引起爆炸;产生的二氧化氮气体来不及被碱液吸收而外逸到空气中.
(6)为了除去可能的杂质和减少产品损失,可分别用冰水和苯洗涤晶体.
12.铝灰的回收利用方法很多,现用含有Al2O3、SiO2和少量FeO•xFe2O3的铝灰制备Al2(SO4)3•18H2O,工艺流程如图:
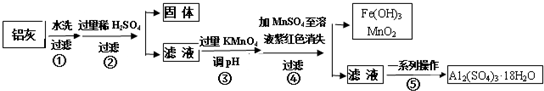
请回答下列问题:
(1)加入过量稀H2SO4溶解Al2O3的离子方程式是6H++Al2O3=2Al3++3H2O.
(2)流程中加入的KMnO4也可用H2O2代替,若用H2O2发生反应的化学方程式为H2O2+2FeSO4+H2SO4=Fe2(SO4)3+2H2O.
(3)已知:浓度均为0.1mol/L的金属阳离子,生成氢氧化物沉淀的pH如表:
步骤③的目的是亚铁离子氧化为铁离子,并将铁离子转化为氢氧化铁沉淀除去;若在该浓度下除去铁的化合物,调节pH的最大范围是2.8≤PH<3.4.
(4)已知Ksp[Fe(OH)3]=c(Fe3+)•c3(OH-)=4.0×10-38,常温下,当pH=2时,Fe3+开始沉淀的浓度为4.0×10-2mol/L.
(5)操作④发生反应的离子方程式为2MnO4-+3Mn2++2H2O=5MnO2↓+4H+.
(6)操作⑤“一系列操作”,下列仪器中用不到的是B(填序号).
A.蒸发皿 B.坩埚 C.玻璃棒 D.酒精灯 E.漏斗.

请回答下列问题:
(1)加入过量稀H2SO4溶解Al2O3的离子方程式是6H++Al2O3=2Al3++3H2O.
(2)流程中加入的KMnO4也可用H2O2代替,若用H2O2发生反应的化学方程式为H2O2+2FeSO4+H2SO4=Fe2(SO4)3+2H2O.
(3)已知:浓度均为0.1mol/L的金属阳离子,生成氢氧化物沉淀的pH如表:
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
(4)已知Ksp[Fe(OH)3]=c(Fe3+)•c3(OH-)=4.0×10-38,常温下,当pH=2时,Fe3+开始沉淀的浓度为4.0×10-2mol/L.
(5)操作④发生反应的离子方程式为2MnO4-+3Mn2++2H2O=5MnO2↓+4H+.
(6)操作⑤“一系列操作”,下列仪器中用不到的是B(填序号).
A.蒸发皿 B.坩埚 C.玻璃棒 D.酒精灯 E.漏斗.
16.天然海水中主要含有Na+、K+、Ca2+、Mg2+、Cl-、SO42-、Br-、CO32-、HCO3-等离子.火力发电燃煤排放的含SO2的烟气可利用海水脱硫,其工艺流程如图所示:
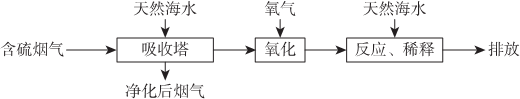
下列说法错误的是( )

下列说法错误的是( )
| A. | 天然海水pH≈8的原因是由于海水中的CO32-、HCO3-水解 | |
| B. | “氧化”是利用氧气将H2SO3、HSO3-、SO32-等氧化生成SO42- | |
| C. | “反应、稀释”时加天然海水的目的是防止净化海水时生成沉淀 | |
| D. | “排放”出来的海水中SO42-的物质的量浓度与进入吸收塔的天然海水相同. |
13.短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示,第三周期中Z元素的简单离子半径最小,下列说法不正确的是( )
| X | Y | |||
| Z | W | Q |
| A. | Z位于第3周期 IIIA族 | |
| B. | X、Z、W、Q等元素的最高正价等于其所在族的族序数 | |
| C. | Y元素气态氢化物比W元素的气态氢化物更稳定,是因为前者分子间形成了氢键 | |
| D. | X的最高价氧化物对应的水化物和X的氢化物形成的化合物含有离子键、共价键 |
14.下列关于卤族元素的说法正确的是( )
| A. | F、Cl、Br、I最高正化合价都为+7 | |
| B. | 卤族元素的单质只有氧化性 | |
| C. | 从F到I,原子的得电子能力依次减弱 | |
| D. | 卤素单质与H2化合的难易程度按F2、Cl2、Br2、I2的顺序由难变易 |
 ,D
,D ,E
,E .
. .
.