题目内容
在Na2SO4和Al2(SO4)3的混合溶液中,测得Al3+浓度为0.1 mol·L-1,SO42-浓度为0.3 mol·L-1,则混合溶液中Na+的浓度为
A.0.3 mol·L-1 B.0.15 mol·L-1
C.0.6 mol·L-1 D.0.45 mol·L-1
A
【解析】
试题分析:溶液呈电中性,根据电荷守恒得0.1 mol·L-1×3+C(Na+)=0.3×2 得C(Na+)=0.3 mol·L-1,选A。
考点:考查溶液中离子浓度的计算。

(22分)现有下列九种物质:
①H2 ②铝 ③CuO ④CO2 ⑤H2SO4 ⑥Ba(OH)2固体 ⑦氨水 ⑧稀硝酸 ⑨熔融Al2(SO4)3
(1)按物质的分类方法填写表格的空白处:
分类标准 | 能导电 | 非电解质 | 电解质 |
属于该类的物质 |
(2)上述九种物质中有两种物质之间可发生离子反应:H++OH- H2O,该离子反应对应的化学方程式为 。
H2O,该离子反应对应的化学方程式为 。
(3)⑨在水中的电离方程式为 ,
34.2g⑨溶于水配成250mL溶液, SO42-的物质的量浓度为 。
(4)少量的④通入⑥的溶液中反应的离子方程式为: 。
(5)将②加入NaOH的溶液中反应的离子方程式
(6)②与⑧发生反应的化学方程式为:Al + 4HNO3 = Al(NO3)3 + NO↑ + 2H2O,该反应的氧化剂是
(填化学式),还原剂与氧化剂的物质的量之比是 ,当有5.4g Al发生反应时,转移电子的物质的量为 。
(12分)在体积不变的2L密闭容器中,进行如下化学反应:CO2(g)+H2(g) 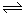 CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表:
t℃ | 500 | 600 | 800 | 900 | 1000 |
K | 0.5 | 0.6 | 1.0 | 1.3 | 1.5 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=________。
(2)该反应正反应为_____反应(选填“吸热”“放热”)。
(3)某温度下,各物质的平衡浓度符合下式:
3c(CO2)·c(H2)=5c(CO)·c(H2O),试判断此时的温度为________。
(4)若800 ℃时,向容器中充入2 mol CO2、2 mol H2,反应进行到5min内,容器内CO的体积分数为20%,则用CO2表示的平均反应速率为 ,达到平衡后,CO2的转化率为 。
(5)800 ℃时,容器中的反应已达到平衡。在其他条件不变的情况下,扩大容器的体积。平衡________移动(填“向正反应方向”“向逆反应方向”或“不”)。
 B.
B. C.
C. D.
D.
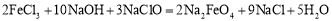
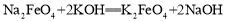 。下列说法不正确的是
。下列说法不正确的是
