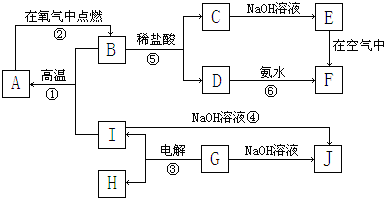
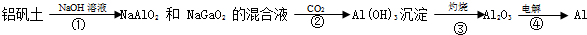题目内容
1molCl2与足量的铁反应,转移的电子数为3NA(判断对错)
考点:化学方程式的有关计算
专题:计算题
分析:Cl2为氧化性较强的非金属单质,和变价金属反应生成高价态的金属氯化物,铁与氯气反应生成氯化铁,但1molCl2与足量的铁反应,氯气量不足,电子转移依据氯气计算分析,据此分析解答.
解答:
解:氯气单质是强氧化剂,能将变价金属氧化到高价态,铁与氯气反应,2Fe+3Cl2
2FeCl3,铁从0价变为+3价,1mol铁失去3mol电子,电子数为N=n×NA=3×NA=3NA,但需1.5mol氯气,
所以1molCl2与足量的铁反应,电子转移依据氯气计算,电子转移为2mol,电子数为N=n×NA=2×NA=2NA,
故答案为:错误.
| ||
所以1molCl2与足量的铁反应,电子转移依据氯气计算,电子转移为2mol,电子数为N=n×NA=2×NA=2NA,
故答案为:错误.
点评:本题考查氯气的性质,为高频考点,注意氯气的强氧化性以及与变价金属反应的特点,氯气为氧化性较强的非金属单质,和变价金属反应生成高价态的金属氯化物,解答本题关键是足量的铁与1mol氯气反应,氯气量不足为易错点,题目难度不大.

练习册系列答案
 黄冈创优卷系列答案
黄冈创优卷系列答案
相关题目
下列关于油脂的叙述错误的是( )
| A、从溴水中提取溴可用植物油做萃取剂 |
| B、用热的纯碱溶液可区别植物油和矿物油 |
| C、含Ca2+、Mg2+的水使肥皂去污能力减弱是因为发生了沉淀反应 |
| D、生产盐酸和人造脂肪必须用氢气做原料 |
光纤通讯是一种现代化的通讯手段,光导纤维的成分是( )
| A、Na2SiO3 |
| B、Si |
| C、SiO2 |
| D、CaCO3 |
N2O5是一种新型绿色硝化剂,其性质和制备受到人们的关注.已知一定条件下会发生反应:2N2O5(g)?4NO2(g)+O2(g)△H>0,平衡常数为K.下列叙述正确的是( )
| A、上述反应的平衡常数随温度升高而增大 |
| B、上述反应达到平衡后,只增大氧气浓度,因为K值变大了,所以平衡将向左移动 |
C、N2O5与苯发生硝化反应除了生成硝基苯(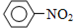 ),还有氧气生成 ),还有氧气生成 |
| D、以N2O4等为原料采用电化学方法可以合成N2O5,该合成应避免碱性环境 |