题目内容
下列选项中的原因或结论与现象不对应的是( )
| 选项 | 现象 | 原因或结论 |
| A | 在 H2O2中加入MnO2,能加速H2O2的分解速率 | MnO2降低了反应所需的活化能 |
| B | 向5mL 0.005mol?L-1FeCl3溶液中加入5mL 0.015mol?L-1KSCN溶液,溶液呈红色,再滴加几滴1mol?L-1KSCN溶液,溶液颜色加深 | 增大反应物浓度,平衡向正反应方向移动 |
| C | 将盛有NO2气体的密闭容器浸泡在热水中,容器内气体颜色变深 | 该反应△H<0,平衡向生成NO2方向移动 |
| D | 在密闭容器中有反应:A+xB(g)?2C(g).达到平衡时测得c(A)为0.5mol/L,将容器容积扩大到原来的两倍,测得c(A)为0.4mol/L-1 | A非气体、x=1 |
| A、A | B、B | C、C | D、D |
考点:化学平衡的影响因素,化学反应速率的影响因素
专题:
分析:A、MnO2是H2O2分解反应中的催化剂,降低了反应所需的活化能;
B、用化学平衡移动的原理解释;
C、2N02?N2O4 △H<0,N2O4无色,用化学平衡移动的原理解释;
D、说明体积增大,压强减小,平衡逆向进行,依据平衡移动方向分析判断选项中的问题.
B、用化学平衡移动的原理解释;
C、2N02?N2O4 △H<0,N2O4无色,用化学平衡移动的原理解释;
D、说明体积增大,压强减小,平衡逆向进行,依据平衡移动方向分析判断选项中的问题.
解答:
解:A、MnO2是H2O2分解反应中的催化剂,降低了反应所需的活化能,故A正确;
B、再滴加几滴1mol?L-1KSCN溶液,增大反应物浓度,平衡向正反应方向移动,故B正确;
C、2N02?N2O4 △H<0,N2O4无色,升高温度平衡逆向移动,故C正确;
D、说明体积增大,压强减小,平衡逆向进行,A如果是非气体浓度不变,所以A为气体,x大于1,故D错误;
故选D.
B、再滴加几滴1mol?L-1KSCN溶液,增大反应物浓度,平衡向正反应方向移动,故B正确;
C、2N02?N2O4 △H<0,N2O4无色,升高温度平衡逆向移动,故C正确;
D、说明体积增大,压强减小,平衡逆向进行,A如果是非气体浓度不变,所以A为气体,x大于1,故D错误;
故选D.
点评:本题考查了催化剂对化学反应速率的影响和化学平衡的移动判断方法,化学平衡的影响因素,平衡移动规律是解题关键.

练习册系列答案
相关题目
如图是模拟工业电解饱和食盐水的装置图,下列叙述不正确的是( )


| A、a 为电源的负极 | ||||
| B、Fe电极的电极反应是4OH--4e-=2H2O+O2↑ | ||||
| C、通电一段时间后,铁电极附近溶液先变红 | ||||
D、电解饱和食盐水的化学方程式是2NaCl+2H2O
|
对食物的酸、碱性判断正确的是( )
| A、大多蔬菜是酸性食物 |
| B、猪肉、牛肉是酸性食物 |
| C、大多水果是碱性食物 |
| D、大米、面粉是碱性食物 |
下列事实与氢键有关的是( )
| A、水加热到很高的温度都难以分解 |
| B、水结成冰体积膨胀,密度变小 |
| C、CH4、SiH4、GeH4、SnH4熔点递增 |
| D、乙醇能与水任意比例互溶 |
 实验室需要0.5mol?L-1硫酸溶液480ml.根据这两种溶液的配制情况回答下列问题:
实验室需要0.5mol?L-1硫酸溶液480ml.根据这两种溶液的配制情况回答下列问题: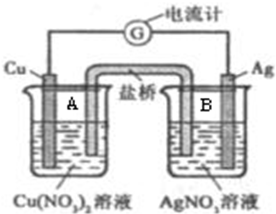 某原电池构造如图所示.其电池的总反应是:Cu(s)+2Ag+(aq)=Cu2+(aq)+2Ag(s).请回答以下问题:
某原电池构造如图所示.其电池的总反应是:Cu(s)+2Ag+(aq)=Cu2+(aq)+2Ag(s).请回答以下问题: