题目内容
常温下,下列事实能说明HClO是弱电解质的是( )
| A、NaClO、HClO都易溶于水 |
| B、HClO与Na2SO3溶液反应,可以得到Na2SO4 |
| C、NaClO的电离方程式:NaClO=Na++ClO- |
| D、0.01 mol?L-1 的HClO溶液pH>2 |
考点:弱电解质的判断
专题:
分析:常温下,部分电离的电解质是弱电解质,完全电离的电解质是强电解质,根据HClO的电离程度判断该酸是否是弱电解质.
解答:
解:A.NaClO、HClO都易溶于水,不能说明HClO的电离程度,所以不能据此判断HClO是弱电解质,故A错误;
B.HClO与Na2SO3溶液反应,可以得到Na2SO4,说明HClO具有氧化性,能氧化亚硫酸钠,但不能说明HClO部分电离,所以不能判断HClO是弱电解质,故B错误;
C.NaClO的电离方程式:NaClO=Na++ClO-,说明NaClO完全电离为强电解质,但不能说明HClO部分电离,所以不能据此判断HClO是弱电解质,故C错误;
D..01 mol?L-1 的HClO溶液pH>2,氢离子浓度小于HClO浓度,说明HClO在水溶液里部分电离,所以能说明该酸是弱电解质,故D正确;
故选D.
B.HClO与Na2SO3溶液反应,可以得到Na2SO4,说明HClO具有氧化性,能氧化亚硫酸钠,但不能说明HClO部分电离,所以不能判断HClO是弱电解质,故B错误;
C.NaClO的电离方程式:NaClO=Na++ClO-,说明NaClO完全电离为强电解质,但不能说明HClO部分电离,所以不能据此判断HClO是弱电解质,故C错误;
D..01 mol?L-1 的HClO溶液pH>2,氢离子浓度小于HClO浓度,说明HClO在水溶液里部分电离,所以能说明该酸是弱电解质,故D正确;
故选D.
点评:本题考查强电解质强弱的判断,明确强弱电解质的本质区别是解本题关键,注意不能根据电解质的溶解性强弱、溶液导电性强弱判断电解质强弱,为易错点.

练习册系列答案
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案
相关题目
对食物的酸、碱性判断正确的是( )
| A、大多蔬菜是酸性食物 |
| B、猪肉、牛肉是酸性食物 |
| C、大多水果是碱性食物 |
| D、大米、面粉是碱性食物 |
下列事实与氢键有关的是( )
| A、水加热到很高的温度都难以分解 |
| B、水结成冰体积膨胀,密度变小 |
| C、CH4、SiH4、GeH4、SnH4熔点递增 |
| D、乙醇能与水任意比例互溶 |
关于水的离子积常数,下列说法不正确的是( )
| A、Kw值随温度升高而增大 |
| B、纯水中,25℃时,c(H+)?c(OH-)=1×10-14 |
| C、25℃时,任何以水为溶剂的稀溶液中c(H+)?c(OH-)=1×10-14 |
| D、蒸馏水中,c(H+)?c(OH-)=1×10-14 |
下列叙述正确的是( )
| A、CH4的摩尔质量是16g |
| B、物质的量是表示含有一定数目粒子集合体的物理量 |
| C、从100mL0.1mol/L盐酸中取出10mL,溶液密度不变 |
| D、4.4gCO2含有0.1mol粒子 |
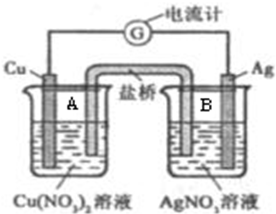 某原电池构造如图所示.其电池的总反应是:Cu(s)+2Ag+(aq)=Cu2+(aq)+2Ag(s).请回答以下问题:
某原电池构造如图所示.其电池的总反应是:Cu(s)+2Ag+(aq)=Cu2+(aq)+2Ag(s).请回答以下问题: