题目内容
18.迷迭香酸是从蜂花属植物中提取得到的酸性物质,其结构如图.则叙述不正确的是( )
| A. | 迷迭香酸属于芳香族化合物 | |
| B. | 1mol迷迭香酸最多能和9mol氢气发生加成反应 | |
| C. | 迷迭香酸可以发生水解反应、取代反应和酯化反应 | |
| D. | 1mol迷迭香酸最多能和含5mol NaOH的水溶液完全反应 |
分析 由结构可知,分子中含酚-OH、-COOH、-COOC-、碳碳双键,结合酚、羧酸、酯、烯烃的性质来解答.
解答 解:A.蛤蟆苯环,属于芳香族化合物,故A正确;
B.2个苯环、1个碳碳双键与氢气发生加成反应,则1mol迷迭香酸最多能和7mol氢气发生加成反应,故B错误;
C.含-COOC-可发生水解、取代反应,含-COOH、-OH可发生酯化反应,故C正确;
D.4个酚-OH、1个-COOH、1个-COOC-与NaOH反应,则1mol迷迭香酸最多能和含6mol NaOH的水溶液完全反应,故D错误;
故选BD.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重分析与应用能力的考查,注意常见有机物性质的应用,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
6.下列事实能用同一原理解释的是( )
| A. | SO2和C12都能用于漂白 | B. | 苯酚、乙烯都能跟溴水反应 | ||
| C. | 苏打、小苏打水溶液的pH都大于7 | D. | I2,NH4Cl晶体受热都逐渐消失 |
13.下列各组中两种物质在溶液中的反应,可用同一离子方程式表示的是( )
| A. | Cu(OH)2+HCl Cu(OH)2+CH3COOH | |
| B. | NaHCO3+H2SO4 Na2CO3+HCl | |
| C. | NaHCO3+NaOH Ca(HCO3)2+NaOH | |
| D. | BaCl2+H2SO4 Ba(NO3)2+H2SO4 |
3.在一定条件下,等物质的量的氯气与碘单质反应,得到一种红棕色液体ICl,ICl有很强的氧化性.现有下列两个反应:①2ICl+2Zn=ZnCl2+ZnI2;②ICl+H2O=HCl+HIO,下列叙述正确的是( )
| A. | Cl2与I2生成ICl是非氧化还原反应 | |
| B. | 反应①中,每生成1 mol ZnCl2时转移2mol电子 | |
| C. | 反应①中,ZnI2既是氧化产物又是还原产物 | |
| D. | 反应②中,ICl既是氧化剂又是还原剂 |
10.毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2•2H2O的流程如图:

已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9
(1)实验室用37%的盐酸配制1mol/L盐酸,下列仪器中,不需要使用的是d
a.容量瓶 b.量筒 c.烧杯 d.滴定管
为了加快毒重石的酸浸速率,可以采取的措施有研磨成粉、加热、搅拌等(至少两条).
(2)加入氨水调节溶液pH=8的目的是使Fe3+形成Fe(OH)3沉淀而除去.滤渣Ⅱ中含Mg(OH)2、Ca(OH)2(填化学式).加入H2C2O4时应避免过量,原因是H2C2O4过量会导致形成BaC2O4沉淀,产品产量减少.
(3)操作Ⅳ的步骤是:蒸发浓缩、冷却结晶、过滤.
(4)利用间接酸碱滴定法可测定Ba2+的含量,实验分两步进行.
已知:2CrO42-+2H+=Cr2O72-+H2O;Ba2++CrO42-=BaCrO4↓
步骤Ⅰ:移取x mL一定浓度的Na2CrO4溶液于锥形瓶中,加入酸碱指示剂,用b mol•L-1盐酸标准液滴定至终点,测得滴加盐酸体积为V0mL.
步骤Ⅱ:移取y mL BaCl2溶液于锥形瓶中,加入x mL与步骤Ⅰ相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用b mol•L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1mL.通过计算,氯化钡溶液浓度为$\frac{(V{\;}_{0}-{V}_{1})b}{y}$ mol•L-1(用含字母的式子表示).

| Ca2+ | Mg2+ | Fe3+ | |
| 开始沉淀的pH | 11.9 | 9.1 | 1.9 |
| 完全沉淀的pH | 13.9 | 11.1 | 3.2 |
(1)实验室用37%的盐酸配制1mol/L盐酸,下列仪器中,不需要使用的是d
a.容量瓶 b.量筒 c.烧杯 d.滴定管
为了加快毒重石的酸浸速率,可以采取的措施有研磨成粉、加热、搅拌等(至少两条).
(2)加入氨水调节溶液pH=8的目的是使Fe3+形成Fe(OH)3沉淀而除去.滤渣Ⅱ中含Mg(OH)2、Ca(OH)2(填化学式).加入H2C2O4时应避免过量,原因是H2C2O4过量会导致形成BaC2O4沉淀,产品产量减少.
(3)操作Ⅳ的步骤是:蒸发浓缩、冷却结晶、过滤.
(4)利用间接酸碱滴定法可测定Ba2+的含量,实验分两步进行.
已知:2CrO42-+2H+=Cr2O72-+H2O;Ba2++CrO42-=BaCrO4↓
步骤Ⅰ:移取x mL一定浓度的Na2CrO4溶液于锥形瓶中,加入酸碱指示剂,用b mol•L-1盐酸标准液滴定至终点,测得滴加盐酸体积为V0mL.
步骤Ⅱ:移取y mL BaCl2溶液于锥形瓶中,加入x mL与步骤Ⅰ相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用b mol•L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1mL.通过计算,氯化钡溶液浓度为$\frac{(V{\;}_{0}-{V}_{1})b}{y}$ mol•L-1(用含字母的式子表示).
7.下列说法正确的是( )
| A. | 0.1 mol•L-1的硫酸铵溶液中:c(NH4+)>c(SO42-)>c(H+)=c(OH-) | |
| B. | 常温下等体积pH相同的CH3COOH和HCl溶液,消耗NaOH的量一样多 | |
| C. | 常温下,醋酸钠与醋酸的混合溶液pH=7:则c(Na+)>c(CH3COO-) | |
| D. | 0.1mol•L-1NaHCO3溶液中:c(Na+)+c(H+)=c(HCO3-)+2 c(CO32-)+c(OH-) |
8.用NA为阿伏加德罗常数的值,下列叙述中正确的是( )
| A. | 25℃时,pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.1NA | |
| B. | 标准状况下,2.24L乙烷含有的化学键总数为0.8NA | |
| C. | 常温下,23gNO2和N2O4的混合气体中含有的氮原子数为0.5 NA | |
| D. | 标准状况下,22.4L甲醇中含有的氧原子数为NA |
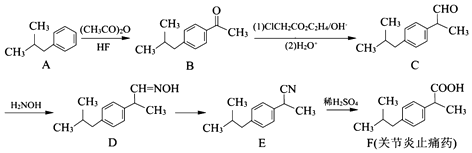
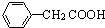 (任写一种);X有多种同分异构体,满足下列条件的X的同分异构体共有3种.
(任写一种);X有多种同分异构体,满足下列条件的X的同分异构体共有3种.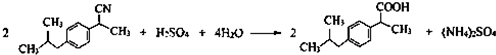 .
.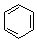 $→_{AlCl_{3}}^{RCl}$
$→_{AlCl_{3}}^{RCl}$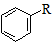

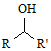 $\stackrel{CO、Pd}{→}$
$\stackrel{CO、Pd}{→}$ R、R′表示烃基
R、R′表示烃基 、苯、(CH3CO)2O为原料来合成,写出有关的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2Br$→_{△}^{NaOH溶液}$CH3CHOH$→_{浓硫酸,△}^{CH_{3}COOH}$CH3COOCH2CH3.
、苯、(CH3CO)2O为原料来合成,写出有关的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2Br$→_{△}^{NaOH溶液}$CH3CHOH$→_{浓硫酸,△}^{CH_{3}COOH}$CH3COOCH2CH3.