题目内容
10.高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂.下列反应可制取K2FeO4:2Fe(OH)3+3Cl2+10KOH$\frac{\underline{\;0-30℃\;}}{\;}$2K2FeO4+6KCl+8H2O,
对于该反应,下列说法正确的是( )
| A. | 该反应是置换反应 | |
| B. | Cl2是氧化剂 | |
| C. | Fe(OH)3发生还原反应 | |
| D. | 每生成1mol K2FeO4转移电子的物质的量为3mol |
分析 2Fe(OH)3+3Cl2+10KOH$\frac{\underline{\;0-30℃\;}}{\;}$2K2FeO4+6KCl+8H2O反应中,Fe元素的化合价升高,被氧化,Cl元素的化合价降低,被还原,以此解答该题.
解答 解:A.反应物、生成物的种类、种数不符合置换反应概念,不是置换反应,故A错误;
B.氯元素的化合价由0将为-1价,发生还原反应,氯气是氧化剂,故B正确;
C.铁元素化合价由+3价升高为+6价,Fe(OH)3发生氧化反应,故C错误;
D.每生成1mol K2FeO4,消耗1.5mol氯气,转移3mol电子,故D正确.
故选:BD.
点评 本题考查氧化还原反应,题目难度不大,注意从元素化合价的角度分析,注意氧化剂与还原剂的区别.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
18.已知强酸与强碱完全反应的中和热为57.3kJ/moL,且生成沉淀要放出热量,下列反应的△H值大于57.3kJ/moL的是( )
| A. | $\frac{1}{2}$H2SO4(aq)+$\frac{1}{2}$Ba(OH)2(aq)═$\frac{1}{2}$BaSO4(s)+H2O(l) | |
| B. | 2KOH(aq)+H2SO4(aq)═K2SO4(aq)+2H2O(l) | |
| C. | CH3COOH(aq)+NaOH(aq)═CH3COONa(aq)+H2O(l) | |
| D. | NH3•H2O(aq)+HCl(aq)═NH4Cl(aq)+H2O(l) |
5.在一固定体积的密闭容器中加入2mol A和1mol B发生反应2A(g)+B(g)?3C(g)+D(g),达到平衡时C的浓度为w mol•L-1,若维持容器的体积和温度不变,按下列四种配比方案作为反应物,达平衡后,使C的浓度仍为w mol•L-1的配比是( )
| A. | 4molA+2molB | B. | 3molC+1molD+2molA+1molB | ||
| C. | 3molC+1molD+1molB | D. | 3molC+1molD |
15.甲、乙两种粒子都只含有一个原子核,且核内具有相同数目的质子,这两种微粒一定是( )
| A. | 同种原子 | B. | 同种元素 | ||
| C. | 互为同位素 | D. | 具有相同的核外电子排布 |
2.下列关于煤及其综合利用的说法中正确的是( )
| A. | 煤的主要成分是单质碳 | |
| B. | 煤的干馏是指将煤在空气中加强热使之分解的过程 | |
| C. | 煤通过干馏得到的苯和甲苯属于同系物 | |
| D. | 煤气化的目的主要是获得甲烷,煤液化的目的主要是获得苯 |
20.下列叙述正确的是( )
| A. | 乙醇、丙三醇互为同系物,同系物之间不可能互为同分异构体 | |
| B. | 液化石油气和天然气的主要成分都是甲烷 | |
| C. | 间二溴苯仅有一种空间结构的事实可证明苯分子中不存在单双键交替的结构 | |
| D. | (CH3)2C=CHCH2CH3分子中的6个碳原子中至少有5个在同一个平面上 |

 .
.
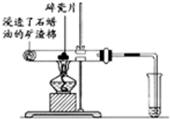 (1)写出下列反应的化学方程式:
(1)写出下列反应的化学方程式: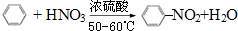 .
.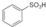 ),根据质量守恒定律,可判断出另一个反应产物为H2O.
),根据质量守恒定律,可判断出另一个反应产物为H2O.