题目内容
8.同温同压下等体积的NH3和CH4两种气体,下列说法错误的是( )| A. | 所含分子数相同 | B. | 质量之比为16:17 | ||
| C. | 所含氢原子的物质的量之比为3:4 | D. | 密度之比为17:16 |
分析 标况下,气体摩尔体积为22.4L/mol,等体积的NH3和CH4两种气体的物质的量相等.
A、根据N=nNA=$\frac{V}{{V}_{m}}$NA计算所含分子数目;
B、根据m=$\frac{V}{{V}_{m}}$M计算其质量之比;
C、根据气体的物质的量结合分子构成确定氢原子的物质的量;
D、根据$ρ=\frac{m}{V}$判断其密度之比.
解答 解:标况下,气体摩尔体积为22.4L/mol.
A、根据N=nNA=$\frac{V}{{V}_{m}}$NA知,相同条件下,气体摩尔体积相同,气体的分子数与气体的体积成正比,所以相同体积的氨气和甲烷,所含分子数相同,故A正确;
B、根据m=$\frac{V}{{V}_{m}}$M知,相同条件下,等体积的氨气和甲烷,其质量与相对分子质量成正比,所以其质量之比=17:16,故B错误;
C、相同条件下,等体积的氨气和甲烷的物质的量相同,一个氨气分子中含有3个H,一个甲烷分子中含有4个H,所以所含氢原子物质的量之比为3:4,故C正确;
D、根据$ρ=\frac{m}{V}$知,相同条件下,气体摩尔体积相同,气体的密度与相对分子质量成之比,所以其密度之比=17:16,故D正确.
故选B.
点评 本题考查了阿伏伽德罗常数的定律及推论,难度不大,注意公式的运用理解与基础知识的掌握.

练习册系列答案
相关题目
18.过氧化钠具有强氧化性.下列说法不正确的是( )
| A. | 过氧化钠与二氧化硫反应时可生成硫酸钠 | |
| B. | 1mol过氧化钠中阴离子数目约为6.02×1023 | |
| C. | Na2O2与CO2反应时,Na2O2是氧化剂CO2是还原剂 | |
| D. | 将等物质的量的Na2O和Na2O2分别溶于等质量的足量水中所得溶液的质量相等 |
19.设NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
| A. | 物质的量浓度为0.5 mol•L-1 的MgCl2溶液,含有的Cl- 数目为0.5NA | |
| B. | 常温常压下,80g SO3含有的氧原子数为3NA | |
| C. | 常温常压下,22.4L H2中所含原子数为2NA | |
| D. | 标准状况下,22.4L水中所含的分子数为NA |
16.如图所示的四种实验操作对应描述正确的是( )
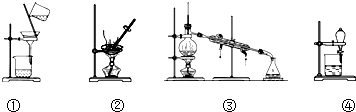

| A. | 除去KCl溶液中的K2CO3,加入适量Ca(NO3)2溶液,再用①装置分离 | |
| B. | 用②装置除去自来水中的Cl-等杂质 | |
| C. | 回收碘的CCl4溶液中的CCl4,可选用③装置 | |
| D. | 分离水和植物油,选用④装置,下层的植物油可从分液漏斗的下层放出 |
3.如图危险标志对应正确的是( )
| A. |  烧碱 | B. |  甲烷 | C. |  酒精 | D. |  白磷 |
13.下列物质转化关系中,必须加入适当氧化剂才能实现的是( )
| A. | NaCl→NaNO3 | B. | MnO4-→Mn2+ | C. | Zn→ZnSO4 | D. | CuO→CuSO4 |
17.同温同压下,下列气体的密度最大的是( )
| A. | 氢气 | B. | 二氧化硫 | C. | 氧气 | D. | 二氧化碳 |
18.氢氧化铁胶体区别于FeCl3溶液最本质的特征( )
| A. | Fe(OH)3胶体粒子的直径在1~100 nm之间 | |
| B. | Fe(OH)3胶体具有丁达尔效应 | |
| C. | Fe(OH)3胶体是均一的分散系 | |
| D. | Fe(OH)3胶体的分散质能通过滤纸 |