题目内容
20.已知H+(ag)+OH-(ag)=H2O(l)△H=-57.3kJ•mol-1.现有以下四个化学反应方程式①H2SO4(aq)+2NaOH(aq)═Na2SO4(aq)+2H2O(l)
②H2SO4(aq)+Ba(OH)2(aq)═BaSO4(s)+2H2O(l);
③HCl(aq)+NH3•H2O(aq)═NH4Cl(aq)+H2O(l);
④CH3COOH(aq)+NH3•H2O(aq)═CH3COONH4(aq)+H2O(l);
其中反应热为△H=-57.3kJ•mol-1的是:( )
.
| A. | ①和③ | B. | ③ | C. | ④ | D. | 以上都不对 |
分析 中和热是强酸和强碱的稀溶液完全反应生成1mol水时放出的热量,依据概念对选项分析判断.
解答 解:①反应生成了2mol水,反应的焓变为-114.6kJ/mol,故不符合;
②反应过程中除了氢离子和氢氧根离子反应放热,硫酸钡沉淀的生成也伴随有沉淀热的变化,反应热大于-57.3kJ•mol-1,故不符合;
③一水合氨是弱电解质电离过程是吸热过程,反应热大于-57.3kJ•mol-1,故不符合;
④一水合氨和醋酸都是弱电解质电离过程是吸热过程,反应热大于-57.3kJ•mol-1,故不符合;
故选D.
点评 本题考查了中和热的概念分析判断,注意酸碱反应过程中的弱电解质电离,反应生成水的量,准确理解概念是解题关键.

练习册系列答案
相关题目
10.对下列各图所示实验现象的描述错误的是( )
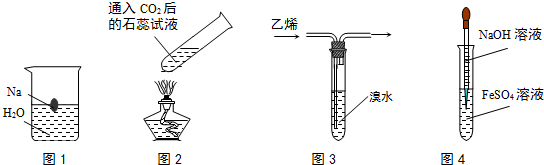

| A. | 图1中溶液颜色变化:无色→红色 | |
| B. | 图2中溶液颜色变化:红色→紫色 | |
| C. | 图3中溴水颜色变化:红棕色→无色 | |
| D. | 图4中生成的沉淀颜色变化:白色→绿色→红褐色 |
11.某同学欲配制符合下列条件的溶液,其中可能实现的是( )
| A. | 标准状况下VL氨气溶解在1L水中(水的密度近似为1g/L),所得溶液的密度为ρg/mL,所配溶液的物质的量浓度c=$\frac{1000Vρ}{(17V+22400)}$ | |
| B. | 只含0.1mol、NH4+、0.1molCa2+、0.1molCO32-和0.1molCl-的溶液 | |
| C. | 质量分数为a%,物质的量浓度为c1mol/L的稀硫酸蒸发水后,其质量分数为2a%,物质的量浓度为c2mol/L,则2c1>c2 | |
| D. | 仅用1 000 mL的容量瓶、烧杯、玻璃棒、量筒、58.5 g NaCl固体和水配制1 L 1 mol/L的NaCl溶液 |
8.同温同压下等体积的NH3和CH4两种气体,下列说法错误的是( )
| A. | 所含分子数相同 | B. | 质量之比为16:17 | ||
| C. | 所含氢原子的物质的量之比为3:4 | D. | 密度之比为17:16 |
12.下列关于原电池和电解池的比较中正确的是( )
| A. | 能量转化形式相同 | B. | 两极的名称相同 | ||
| C. | 负极和阴极上移向的离子类别相同 | D. | 负极和阳极上发生的反应类型相同 |
10.下列各组顺序的排列错误的是( )
| A. | 沸点:H2O<H2S<H2Se | B. | 半径:F->Na+>Mg2+>Al3+ | ||
| C. | 酸性:HClO4>H2SO4>H3PO4 | D. | 熔点:SiO2>NaCl>CO2 |
 .
.