题目内容
4.分类思想是中学化学的核心思想,分类均有一定标准.下列有关说法正确的是 ( )| A. | SiO2、NaHCO3均可能与强酸、强碱反应,都为两性物质 | |
| B. | Na2CO3、CH3COOH、Cu2(OH)2CO3均含有碳元素,都是有机化合物 | |
| C. | BaCO3、BaSO3、BaSO4均难溶于水,均属于难溶电解质 | |
| D. | HCOOH、H2CO3、H2SO4分子中均含有两个氢原子,都是二元酸 |
分析 A.两性物质是指既能与酸反应又能与碱反应生成产物都是盐和水;
B.一般含碳的化合物为有机物,但二氧化碳、一氧化碳、碳酸盐等组成和性质符合无机物特征为无机物;
C.电解质是水溶液中或熔融状态导电的化合物,碳酸钡、亚硫酸钡、硫酸钡都难溶于水;
D.按电水溶液中离出的氢离子的个数,酸可以分为一元酸、二元酸和多元酸.
解答 解:A.SiO2只和氢氟酸反应是特征性质,不是两性氧化物,NaHCO3与盐酸反应生成氯化钠和水、二氧化碳,不符合两性物质的概念,不属于两性物质,故A错误;
B.CH3COOH含有碳元素,是有机化合物,Na2CO3,Cu2(OH)2CO3均含碳元素但组成和性质符合无机物特征,属于无机物,故B错误;
C.BaCO3、BaSO3、BaSO4均难溶于水,熔融状态完全电离均属于难溶电解质,故C正确;
D.按电离出的氢离子的个数,酸可以分为一元酸、二元酸和多元酸,H2CO3、H2SO4分子电离出2个氢离子为二元酸,HCOOH只能电离出一个氢离子,为一元酸,故D错误.
故选C.
点评 本题考查了有关化学概念,明确两性物质的性质、电解质的概念、有机物和无机物的概念是解题关键,注意酸的分类中按照电离出氢离子数分为几元酸,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.下列装置或操作能达到实验目的是( )
| A. | 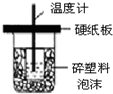 如图装置用于中和热的测定 | |
| B. | 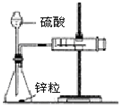 如图装置用于测定氢气的反应速率(单位mL/s) | |
| C. | 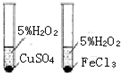 如图装置用于研究催化剂Cu2+和Fe3+对反应速率的影响 | |
| D. | 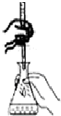 如图装置用于已知浓度的高锰酸钾溶液测定未知浓度的草酸溶液 |
1.设NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A. | 1 mol Cl2与足量Fe反应,转移的电子数为3NA | |
| B. | 常温下,500mL 2mol•L-1的Na2CO3溶液中含Na+数目为2NA | |
| C. | 1.8gNH4+的离子中含有的质子数为0.1NA | |
| D. | 标准状况下,1 L水所含分子数为NA |
8. 甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素.
甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素.
(1)该反应的离子方程式为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.
设计实验方案如下(实验中所用MnSO4对该反应有催化作用):
(2)甲组:通过测定单位时间内生成CO2气体体积的大小来比较化学反应速率的大小.实验装置如图,实验时分液漏斗中A溶液一次性放下,A、B的成分见表:
该实验探究的是浓度和催化剂对化学反应速率的影响.在反应停止之前,相同时间内针管中所得CO2的体积由大到小的顺序是③>②>①(用实验序号填空).
(3)乙组:通过测定KMnO4溶液褪色所需时间的多少来比较化学反应速率的大小.取两支试管各加入2mL 0.1mol/L H2C2O4溶液,另取两支试管各加入4mL 0.1mol/L KMnO4溶液.将四支试管分成两组(各有一支盛有H2C2O4溶液和KMnO4溶液的试管),一组放入冷水中,另一组放入热水中,经过一段时间后,分别混合并振荡,记录溶液褪色所需时间.该实验目的是研究温度对化学反应速率的影响,但该组同学始终没有看到溶液褪色,其原因是没有加入稀硫酸酸化或高锰酸钾过量导致.
 甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素.
甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素.(1)该反应的离子方程式为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.
设计实验方案如下(实验中所用MnSO4对该反应有催化作用):
(2)甲组:通过测定单位时间内生成CO2气体体积的大小来比较化学反应速率的大小.实验装置如图,实验时分液漏斗中A溶液一次性放下,A、B的成分见表:
| 序号 | A溶液 | B溶液 |
| ① | 2mL 0.1mol/L H2C2O4溶液 | 4mL 0.01mol/L KMnO4酸性溶液 |
| ② | 2mL 0.2mol/L H2C2O4溶液 | 4mL 0.01mol/L KMnO4酸性溶液 |
| ③ | 2mL 0.2mol/L H2C2O4溶液 | 4mL 0.01mol/L KMnO4酸性溶液和少量MnSO4 |
(3)乙组:通过测定KMnO4溶液褪色所需时间的多少来比较化学反应速率的大小.取两支试管各加入2mL 0.1mol/L H2C2O4溶液,另取两支试管各加入4mL 0.1mol/L KMnO4溶液.将四支试管分成两组(各有一支盛有H2C2O4溶液和KMnO4溶液的试管),一组放入冷水中,另一组放入热水中,经过一段时间后,分别混合并振荡,记录溶液褪色所需时间.该实验目的是研究温度对化学反应速率的影响,但该组同学始终没有看到溶液褪色,其原因是没有加入稀硫酸酸化或高锰酸钾过量导致.
5.发明元素周期表的科学家是( )
| A. | 道尔顿 | B. | 牛顿 | C. | 门捷列夫 | D. | 爱迪生 |
6.下列实验操作不能达到其对应目的是( )
| 序号 | 实验内容 | 实验目的 |
| A | 在淀粉溶液中加入稀硫酸,水浴加热,一段时间后,再加入少量新制的氢氧化铜悬浊液并加热 | 验证淀粉已水解 |
| B | 向2 mL甲苯中加入3滴KMnO4酸性溶液,振荡;向2mL己烷中加入3滴KMnO4酸性溶液,振荡 | 证明与苯环相连的甲基易被氧化 |
| C | 在苯酚溶液中加入溴水 | 用FeCl3溶液可检验苯酚是否完全反应 |
| D | 用苯与浓H2SO4和浓HNO3制备硝基苯,将产物倒入NaOH溶液中,静置,分液 | 除去硝基苯中混有浓H2SO4和浓HNO3 |
| A. | A | B. | B | C. | C | D. | D |
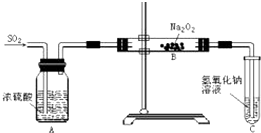 有两个实验小组的同学为探究过氧化钠与二氧化硫反应,都用如图所示的装置进行实验.通入SO2气体,将带余烬的木条插入试管C中,木条复燃.
有两个实验小组的同学为探究过氧化钠与二氧化硫反应,都用如图所示的装置进行实验.通入SO2气体,将带余烬的木条插入试管C中,木条复燃.