题目内容
5.发明元素周期表的科学家是( )| A. | 道尔顿 | B. | 牛顿 | C. | 门捷列夫 | D. | 爱迪生 |
分析 1869年,俄国化学家门捷列夫发现了元素周期律,并编制出元素周期表,使得化学学习和研究变得有规律可循.
解答 解:A.道尔顿提出了近代原子学说,故A错误.
B.牛顿发现了万有引力定律,故B错误;
C.俄国化学家门捷列夫发现了元素周期律,并编制出元素周期表,故C正确;
D.爱迪生发明了电灯泡,故D错误.
故选C.
点评 本题主要考查了化学史,难度不大,平时注意知识的积累,属于基础性题目.

练习册系列答案
相关题目
3.下列实验操作及现象结论描述不准确的是( )
| A. | 向沸水中滴加饱和氯化铁溶液制备胶体,用可见光束照射,产生丁达尔效应 | |
| B. | 常温下,向0.10mol•L-1NaHCO3溶液,滴加CaCl2溶液至pH=7,滴加过程中产生白色沉淀,但无气体放出,说明加入CaCl2促进了HCO3-的水解 | |
| C. | 利用以下实验器材(规格数量不限):烧杯、量筒、环形玻璃搅拌棒、纸条、硬纸板、温度计能完成中和反应反应热的测定 | |
| D. | 向浓度均为0.1mol•L-1的MgCl2、CuCl2混合溶液中逐滴加入氨水,先出现蓝色沉淀,因为KSP[Mg(OH)2]>KSP[Cu(OH)2] |
4.分类思想是中学化学的核心思想,分类均有一定标准.下列有关说法正确的是 ( )
| A. | SiO2、NaHCO3均可能与强酸、强碱反应,都为两性物质 | |
| B. | Na2CO3、CH3COOH、Cu2(OH)2CO3均含有碳元素,都是有机化合物 | |
| C. | BaCO3、BaSO3、BaSO4均难溶于水,均属于难溶电解质 | |
| D. | HCOOH、H2CO3、H2SO4分子中均含有两个氢原子,都是二元酸 |
13.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 标准状况下,4.48LCHCl3的分子数为0.2 NA | |
| B. | 常温常压下,8gCH4含有5NA个电子 | |
| C. | 6.0g冰醋酸与4.6g乙醇反应生成乙酸乙酯的分子数为0.1 NA | |
| D. | 28 g由C2H4和C3H6组成的混合物中含有氢原子的数目为4 NA |
20.下列说法不正确的是( )
| A. | -OH与OH-具有相同的质子数 | |
| B. | 在葡萄糖溶液中加入银氨溶液,一会儿就会看到光亮的银析出 | |
| C. | 检验乙醇中是否含有水可用无水硫酸铜 | |
| D. | 某有机物在氧气中燃烧生成CO2和H2O,则该有机物可能是烃 |
10. 决定物质性质的重要因素是物质结构.请回答下列问题.
决定物质性质的重要因素是物质结构.请回答下列问题.
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如表所示:
A通常显+3价,A的电负性>B的电负性(填“>”、“<”或“=”).
(2)紫外光的光子所具有的能量约为399kJ•mol-1.根据如表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因:紫外光具有的能量比蛋白质分子中重要的化学键C-C、C-N和C-S的键能都大,紫外光的能量足以使这些化学键断裂,从而破坏蛋白质分子.
组成蛋白质的最简单的氨基酸中的碳原子杂化类型是sp2和sp3杂化.
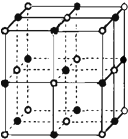
(3)实验证明:KCl、CaO这2种晶体的结构与NaCl晶体结构相似(如图所示):
则KCl、CaO这2种晶体熔点从高到低的顺序是:CaO>KCl,其原因是离子半径越小,离子所带电荷越多,晶格能越大,熔点越高 (从影响晶格能大小的因素进行描述).其中CaO晶体中一个Ca2+周围和它最邻近且等距离的Ca2+有12个.
(4)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好.离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是CrO2.
 决定物质性质的重要因素是物质结构.请回答下列问题.
决定物质性质的重要因素是物质结构.请回答下列问题.(1)已知A和B为第三周期元素,其原子的第一至第四电离能如表所示:
| 电离能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
(2)紫外光的光子所具有的能量约为399kJ•mol-1.根据如表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因:紫外光具有的能量比蛋白质分子中重要的化学键C-C、C-N和C-S的键能都大,紫外光的能量足以使这些化学键断裂,从而破坏蛋白质分子.
组成蛋白质的最简单的氨基酸中的碳原子杂化类型是sp2和sp3杂化.
| 共价键 | C-C | C-N | C-S |
| 键能/kJ•mol-1 | 347 | 305 | 259 |
则KCl、CaO这2种晶体熔点从高到低的顺序是:CaO>KCl,其原因是离子半径越小,离子所带电荷越多,晶格能越大,熔点越高 (从影响晶格能大小的因素进行描述).其中CaO晶体中一个Ca2+周围和它最邻近且等距离的Ca2+有12个.
(4)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好.离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是CrO2.
17.第一次用无机物制得有机物尿素,开辟人工合成有机物先河的科学家是( )
| A. | 德国的维勒 | B. | 瑞典的贝采里乌斯 | ||
| C. | 德国的李比希 | D. | 匈牙利的海维西 |
15.世界卫生组织把铝确认为食品污染源之一,铝的下列应用必须加以控制的是( )
| A. | 用铝合金制作门窗 | B. | 用铝合金制作飞机材料 | ||
| C. | 用金属铝制盛装碳酸饮料的易拉罐 | D. | 用金属铝制作电线 |