题目内容
7.①~⑨是元素周期表中的部分元素.族 周期 | ⅠA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
| 4 | ⑨ | |||||||
(1)元素⑤和⑦的最高价氧化物对应水化物反应的离子方程式是OH-+Al(OH)3=AlO2-+2H2O.
(2)用电子式表示元素⑥和⑨形成的化合物的过程
 .
.(3)某同学为了比较元素②和硅元素非金属性的相对强弱,用下图所示装置进行实验(夹持仪器已略去,气密性已检验).请回答:
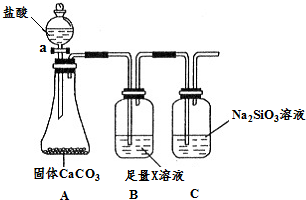
a.X是NaHCO3(填化学式),B装置的作用是吸收二氧化碳中混有的HCl气体.
b.能说明元素②和硅元素非金属性强弱的实验现象是C中产生白色胶状沉淀,相关的化学方程式是:CO2+H2O+Na2SiO3=Na2CO3+H2SiO3↓.
(4)请设计实验比较元素⑥与⑦金属性的相对强弱取一小段镁条和一小片铝片,磨去表面氧化膜,分别放入2支试管中,各加入等体积等浓度的盐酸,观察发生的现象.
分析 由元素在周期表中位置,可知①为H、②为C、③为O、④为F、⑤为Na、⑥为Mg、⑦为Al、⑧为Cl、⑨为Br.
(1)NaOH与氢氧化铝反应生成偏铝酸钠和水;
(2)元素⑥和⑨形成的化合物为MgBr2,为离子化合物;
(3)非金属性越强,最高价含氧酸的酸性越强,利用强酸制备弱酸,由图可知,X为碳酸氢钠溶液可除去HCl,C中发生二氧化碳与硅酸钠溶液的反应生成硅酸;
(4)金属性越强,与酸反应越剧烈.
解答 解:由元素在周期表中位置,可知①为H、②为C、③为O、④为F、⑤为Na、⑥为Mg、⑦为Al、⑧为Cl、⑨为Br.
(1)NaOH与氢氧化铝反应生成偏铝酸钠和水,离子反应为OH-+Al(OH)3=AlO2-+2H2O,故答案为:OH-+Al(OH)3=AlO2-+2H2O;
(2)用电子式表示元素⑥和⑨形成的化合物的过程为 ,
,
故答案为: ;
;
(3)非金属性越强,最高价含氧酸的酸性越强,利用强酸制备弱酸,由图可知,X为碳酸氢钠溶液可除去HCl,C中发生二氧化碳与硅酸钠溶液的反应生成硅酸,则
a.X为NaHCO3,B装置的作用为吸收二氧化碳中混有的HCl气体,故答案为:NaHCO3;吸收二氧化碳中混有的HCl气体;
b.C中发生CO2+H2O+Na2SiO3=Na2CO3+H2SiO3↓可以说明C的非金属性比Si强,观察到产生白色胶状沉淀,
故答案为:C中产生白色胶状沉淀;CO2+H2O+Na2SiO3=Na2CO3+H2SiO3↓;
(4)比较元素⑥与⑦金属性的相对强弱的实验为取一小段镁条和一小片铝片,磨去表面氧化膜,分别放入2支试管中,各加入等体积等浓度的盐酸,观察发生的现象(其他合理答案,如与热水、原电池、最高价氧化物的水化物的碱性比较等均可),
故答案为:取一小段镁条和一小片铝片,磨去表面氧化膜,分别放入2支试管中,各加入等体积等浓度的盐酸,观察发生的现象.
点评 本题考查位置、结构与性质的关系,为高频考点,把握元素的位置、元素的性质、元素化合物知识为解答的关键,侧重分析与应用能力的考查,注意相关反应原理及元素化合物知识的综合应用,题目难度不大.

 阅读快车系列答案
阅读快车系列答案
| A. | SO2和NxOy都属于酸性氧化物 | |
| B. | 苯是最简单的芳香烃 | |
| C. | 重金属离子可导致蛋白质变性 | |
| D. | 汽车尾气的大量排放是造成雾霾天气的人为因素之一 |
| A. | 卤素的氢化物中沸点最低的是HF | |
| B. | 因为H2O分子间有氢键,所以H2O比H2S稳定 | |
| C. | 一个X原子的质量为ag,则X元素的相对原子质量为aNA | |
| D. | 熔沸点:NH3<PCl3 |
①a=b+6 ②a+b=8 ③a+b=30 ④a=b+8.
| A. | ①②③ | B. | ①②④ | C. | ②③④ | D. | ①②③④ |

| A. | 靛蓝由碳、氢、氧、氮四种元素组成 | B. | 它的分子式是C16H10N2O2 | ||
| C. | 该物质不属于烃 | D. | 它是不饱和烃 |
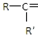 $\frac{\underline{\;氧化成\;}}{\;}$
$\frac{\underline{\;氧化成\;}}{\;}$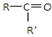 (R、R′可表示烃基或官能团),若将A中两化合物看作是某单烯烃被臭氧氧化生成的,则该单烯烃的结构简式为CH3CH2CH2CH=C(CH3)CH2CH3.
(R、R′可表示烃基或官能团),若将A中两化合物看作是某单烯烃被臭氧氧化生成的,则该单烯烃的结构简式为CH3CH2CH2CH=C(CH3)CH2CH3.