题目内容
19.pH=2的盐酸与pH=12的 氢氧化钠溶液等体积混合后,溶液中各离子浓度的关系是c(Na+)=c(Cl-)>c(H+)=c(OH-).分析 pH=2的盐酸与pH=12的 氢氧化钠溶液等体积混合后,两者恰好完全反应生成氯化钠,氯化钠溶液呈中性,由此分析解答.
解答 解:pH=2的盐酸与pH=12的 氢氧化钠溶液等体积混合后,两者恰好完全反应生成氯化钠,氯化钠溶液呈中性,所以离子浓度大小为:c(Na+)=c(Cl-)>c(H+)=c(OH-),故答案为:c(Na+)=c(Cl-)>c(H+)=c(OH-).
点评 本题考查离子浓度大小比较,题目难度中等,本题注意把握电解质的电离和盐类水解的原理,运用守恒的思想解答该类题目.

练习册系列答案
相关题目
6.实验室提纯含少量氯化钠杂质的硝酸钾的过程如图所示.下列分析正确的是( )
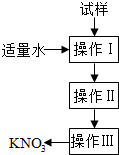

| A. | 操作Ⅰ是过滤,将固体分离除去 | |
| B. | 操作Ⅱ是加热浓缩.趁热过滤,除去杂质氯化钠 | |
| C. | 操作Ⅲ是过滤、洗涤,将硝酸钾晶体从溶液中分离出来 | |
| D. | 操作Ⅰ~Ⅲ总共需两次过滤 |
7.①~⑨是元素周期表中的部分元素.
请回答:
(1)元素⑤和⑦的最高价氧化物对应水化物反应的离子方程式是OH-+Al(OH)3=AlO2-+2H2O.
(2)用电子式表示元素⑥和⑨形成的化合物的过程 .
.
(3)某同学为了比较元素②和硅元素非金属性的相对强弱,用下图所示装置进行实验(夹持仪器已略去,气密性已检验).请回答:
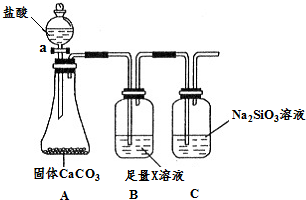
a.X是NaHCO3(填化学式),B装置的作用是吸收二氧化碳中混有的HCl气体.
b.能说明元素②和硅元素非金属性强弱的实验现象是C中产生白色胶状沉淀,相关的化学方程式是:CO2+H2O+Na2SiO3=Na2CO3+H2SiO3↓.
(4)请设计实验比较元素⑥与⑦金属性的相对强弱取一小段镁条和一小片铝片,磨去表面氧化膜,分别放入2支试管中,各加入等体积等浓度的盐酸,观察发生的现象.
族 周期 | ⅠA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
| 4 | ⑨ | |||||||
(1)元素⑤和⑦的最高价氧化物对应水化物反应的离子方程式是OH-+Al(OH)3=AlO2-+2H2O.
(2)用电子式表示元素⑥和⑨形成的化合物的过程
 .
.(3)某同学为了比较元素②和硅元素非金属性的相对强弱,用下图所示装置进行实验(夹持仪器已略去,气密性已检验).请回答:

a.X是NaHCO3(填化学式),B装置的作用是吸收二氧化碳中混有的HCl气体.
b.能说明元素②和硅元素非金属性强弱的实验现象是C中产生白色胶状沉淀,相关的化学方程式是:CO2+H2O+Na2SiO3=Na2CO3+H2SiO3↓.
(4)请设计实验比较元素⑥与⑦金属性的相对强弱取一小段镁条和一小片铝片,磨去表面氧化膜,分别放入2支试管中,各加入等体积等浓度的盐酸,观察发生的现象.
14.下列关于资源及其利用的说法正确的是( )
| A. | 煤的干馏,石油的裂化和裂解均属于化学变化 | |
| B. | 利用铝热反应可以冶炼Fe、Cr、Mn、W、Na等金属 | |
| C. | 甲烷和氯气制备一氯甲烷的原子利用率可达100% | |
| D. | SO2、NO2、CO2均是导致酸雨的主要原因 |
4.下列试剂是因为空气中的氧气而变质的是( )
| A. | 亚硫酸钠 | B. | 氢氧化钠 | C. | 过氧化钠 | D. | 碳酸氢钠 |
9.下列溶液中的c(Cl-)与50mL 1mol•L-1 AlCl3溶液中c(Cl-)相等的是( )
| A. | 150mL 1mol•L-1 NaCl溶液 | B. | 75mL 2mol•L-1 NH4Cl溶液 | ||
| C. | 50mL 3mol•L-1KClO3溶液 | D. | 50mL 1mol•L-1 FeCl3溶液 |
 3,4-二甲基辛烷.
3,4-二甲基辛烷. 2,3,4-三甲基己烷.
2,3,4-三甲基己烷.