题目内容
17.将一定量的Cl2通入体积为40mL、浓度为7.5mol/L的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),测得反应后溶液中有三种含氯元素的离子,其中ClO-物质的量为0.06mol和ClO3-物质的量0.03mol,下列说法不正确的是( )| A. | 该反应的离子方程式为:5Cl2+10 OH-═7Cl-+2ClO-+ClO3-+5H2O | |
| B. | 该反应中,氧化剂与还原剂物质的量之比为5:3 | |
| C. | 上述苛性钾溶液中含有0.3mol的KOH | |
| D. | 反应后生成的ClO-和 ClO3- 两种离子在一定条件下均有氧化性 |
分析 40mL、浓度为7.5mol/L的苛性钾溶液的物质的量为:7.5mol/L×0.04L=0.3mol,根据得失电子守恒可知:ClO-物质的量为0.06mol和ClO3-物质的量0.03mol,n(Cl-)=5n(ClO3-)+n(ClO-)=0.03×5+0.06=0.21mol,n(Cl-):n(ClO-):n(ClO3-)=0.21:0.06:0.03=7:2:1,所以反应方程式为:5Cl2+10 OH-═7Cl-+2ClO-+ClO3-+5H2O,由此分析解答.
解答 解:40mL、浓度为7.5mol/L的苛性钾溶液的物质的量为:7.5mol/L×0.04L=0.3mol,根据得失电子守恒可知:ClO-物质的量为0.06mol和ClO3-物质的量0.03mol,n(Cl-)=5n(ClO3-)+n(ClO-)=0.03×5+0.06=0.21mol,n(Cl-):n(ClO-):n(ClO3-)=0.21:0.06:0.03=7:2:1,所以反应方程式为:5Cl2+10 OH-═7Cl-+2ClO-+ClO3-+5H2O,
A、由分析知:反应的离子方程式为:5Cl2+10 OH-═7Cl-+2ClO-+ClO3-+5H2O,故A正确;
B、氧化剂与还原剂物质的量之比为0.21:(0.06+0.03)=7:3,故B错误;
C、40mL、浓度为7.5mol/L的苛性钾溶液的物质的量为:7.5mol/L×0.04L=0.3mol,故C正确;
D、反应后生成的ClO-和 ClO3- 中氯的化合价分别为+1和+5价,处于较高价态,化合价可以降低,具有氧化性,故D正确;
故选B.
点评 本题混合物反应的计算,题目难度中等,判断溶液中n(Cl-)=5n(ClO3-)+n(ClO-)是解题关键,注意明确守恒思想在化学计算中的应用方法.

 口算能手系列答案
口算能手系列答案| A. | 1:1 | B. | 1:2 | C. | 2:1 | D. | 2:3 |
| 被提纯物质 | 除杂试剂 | 分离方法 | |
| A | 溴化钠溶液(NaI) | 氯水、CCl4 | 萃取、分液 |
| B | 氯化铵溶液(FeCl3) | 氢氧化钠溶液 | 过滤 |
| C | 二氧化碳(CO) | 氧化铜粉末 | 通过灼热的CuO粉末 |
| D | 苯(苯酚) | 浓溴水 | 过滤 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 氢氟酸易与SiO2反应,可用于刻蚀玻璃 | |
| B. | Al和Fe2O3能发生铝热反应,可用于焊接钢轨 | |
| C. | NH3具有碱性,可用NH3与灼热的CuO作用制取少量N2 | |
| D. | Fe具有良好的导电性,可用Fe作电解食盐水的阴极材料 |
①蒸馏水 ②NaOH溶液 ③红色石蕊试纸 ④蓝色石蕊试纸 ⑤稀硫酸.
| A. | ①②③ | B. | ①②④ | C. | ②③ | D. | ①③⑤ |
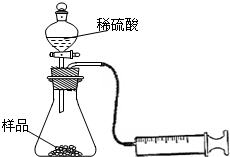 某学校化学科研小组从文献资料上获得如下信息:NaHCO3在潮湿的空气中会缓慢分解成Na2CO3、H2O和CO2.为了验证这一信息,该科研小组将一瓶在潮湿空气中久置的NaHCO3样品混合均匀后,进行如下实验:
某学校化学科研小组从文献资料上获得如下信息:NaHCO3在潮湿的空气中会缓慢分解成Na2CO3、H2O和CO2.为了验证这一信息,该科研小组将一瓶在潮湿空气中久置的NaHCO3样品混合均匀后,进行如下实验: