题目内容
1.设NA表示阿伏伽德罗常数,正确的是( )| A. | 20°C时,28g N2所含的原子数为2NA个 | |
| B. | 标况下,0.5NA个水分子所占体积约为11.2L | |
| C. | CH4的摩尔质量在数值上等于NA个甲烷分子的质量之和 | |
| D. | 1gCO与1gCO2所含碳原子数之比是1:1 |
分析 A、求出氮气的物质的量,然后根据氮气为双原子分子来分析;
B、标况下水为液体;
C、1mol物质所具有的质量称为此物质的摩尔质量;
D、CO和二氧化碳的摩尔质量不同,但均含一个碳原子.
解答 解:A、28g氮气的物质的量为1mol,而氮气为双原子分子,故1mol氮气中含2mol氮原子即2NA个,故A正确;
B、标况下水为液体,故不能根据气体摩尔体积来计算其体积,故B错误;
C、1mol物质所具有的质量称为此物质的摩尔质量,甲烷的摩尔质量为16g/mol,而NA个甲烷分子即1mol甲烷的质量为16g,故两者在数值上相同,故C正确;
D、CO和二氧化碳的摩尔质量不同,故1gCO和1g二氧化碳的物质的量不同,但两者均含一个碳原子,故物质的量不等的两者中含有的碳原子个数不等,故D错误.
故选AC.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.

练习册系列答案
相关题目
9.某有机物结构简式如图 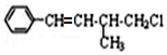 下列叙述不正确的是( )
下列叙述不正确的是( )
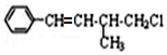 下列叙述不正确的是( )
下列叙述不正确的是( )| A. | 1mol 该有机物在加热和催化剂作用下,最多能和4 mol H2反应 | |
| B. | 该有机物分子式为C11H13Cl | |
| C. | 该有机物能通过加成、消去、水解三步反应生成: | |
| D. | 该有机物遇硝酸银溶液不能产生白色沉淀 |
16.黄铁矿(主要成分FeS2)、黄铜矿(主要成分CuFeS2)均是自然界中的常见矿物资源.
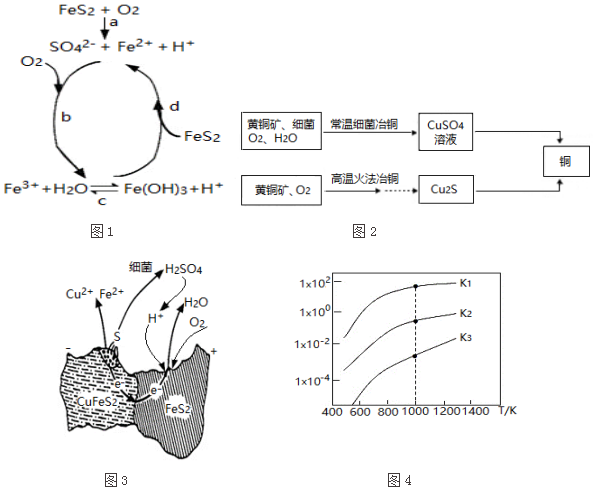
(1)黄铁矿在空气中易被氧化,其反应历程可能为如图1所示的四步:
①a反应中每生成1molFeSO4转移电子的物质的量为7mol.
②d反应的离子方程式为FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+.
(2)用黄铜矿常温细菌冶铜和高温火法冶铜的流程如图2所示:
①细菌冶铜时,当黄铜矿中伴有黄铁矿可明显提高Cu2+的浸出速率,
其原理如图3所示:
Ⅰ.冶炼过程中,FeS2周边溶液的pH增大(填“增大”、“减小”或“不变”).
Ⅱ.从CuFeS2析出S的反应式是CuFeS2-4e-=Cu2++Fe2++2S.
②火法冶铜时,由Cu2S制得铜的化学方程式是Cu2S+O2 $\frac{\underline{\;高温\;}}{\;}$2Cu+SO2.
(3)煤炭中的硫主要以黄铁矿形式存在,用氢气脱除黄铁矿中硫的相关反应(见表),其相关反应的平衡常数与温度的关系如图4.
①上述反应中,△H1>0(填“>”或“<”).
②提高硫的脱除率可采取的措施有升高温度(举1例).

(1)黄铁矿在空气中易被氧化,其反应历程可能为如图1所示的四步:
①a反应中每生成1molFeSO4转移电子的物质的量为7mol.
②d反应的离子方程式为FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+.
(2)用黄铜矿常温细菌冶铜和高温火法冶铜的流程如图2所示:
①细菌冶铜时,当黄铜矿中伴有黄铁矿可明显提高Cu2+的浸出速率,
其原理如图3所示:
Ⅰ.冶炼过程中,FeS2周边溶液的pH增大(填“增大”、“减小”或“不变”).
Ⅱ.从CuFeS2析出S的反应式是CuFeS2-4e-=Cu2++Fe2++2S.
②火法冶铜时,由Cu2S制得铜的化学方程式是Cu2S+O2 $\frac{\underline{\;高温\;}}{\;}$2Cu+SO2.
(3)煤炭中的硫主要以黄铁矿形式存在,用氢气脱除黄铁矿中硫的相关反应(见表),其相关反应的平衡常数与温度的关系如图4.
| 相关反应 | 反应热 | 平衡常数 |
| FeS2(s)+H2(g)?FeS(s)+H2S(g) | △H1 | K1 |
| $\frac{1}{2}$FeS2(s)+H2(g)?$\frac{1}{2}$Fe(s)+H2S(g) | △H2 | K2 |
| FeS(s)+H2(g)?Fe(s)+H2S(g) | △H3 | K3 |
②提高硫的脱除率可采取的措施有升高温度(举1例).
6.甲.乙两同学分别对含+4价硫元素的物质性质进行了探究.
(1)甲用如图装置进行实验(气密性已检验,加热和夹持装置已略去).实验进行一段时间后,C、D中都出现明显的白色沉淀,经检验均为BaSO4.
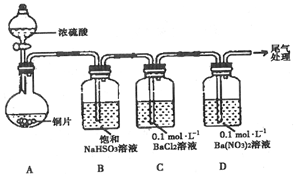
①A中反应的化学方程式是Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
②为探究SO2在D中所发生的反应,甲进一步实验发现,出现白色沉淀的过程中,D溶液中NO3浓度几乎不变.甲据此得出结论:C、D中出现白色沉淀的主要原因是在酸性条件下,+4价硫被A(填序号)氧化成SO42-.
A.O2 B.Ba2+ C.NO3-
(2)乙用如下实验对含+4价硫元素的物质性质继续进行探究.(均在敞口容器中)
①用离子方程式解释实验1中产生现象的原因2H++SO32-═SO2+H2O,2SO2+O2+2Ba2++2H2O═2BaSO4↓+4H+或2H2SO3+O2+2Ba2+═2BaSO4↓+4H+.
②由实验1、2、3对比,可以得到推论:含+4价硫元素物质可被O2和浓HNO3氧化.
③乙通过查阅资料发现:Na+对实验1和2中出现浑.浊的时间无影响,于是进一步探究Cl-和NO3-对其的影响:
i.实验2和4对比,乙获得推论:Cl-的存在可以加快溶液中+4价硫元素的氧化;
ii.实验1和4对比,乙获得推论:NO3-的存在可以减慢溶液中+4价硫元素的氧化.
④通过以上实验,可以推测B装置最有可能的作用是吸收+6价硫的化合物.
(1)甲用如图装置进行实验(气密性已检验,加热和夹持装置已略去).实验进行一段时间后,C、D中都出现明显的白色沉淀,经检验均为BaSO4.

①A中反应的化学方程式是Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
②为探究SO2在D中所发生的反应,甲进一步实验发现,出现白色沉淀的过程中,D溶液中NO3浓度几乎不变.甲据此得出结论:C、D中出现白色沉淀的主要原因是在酸性条件下,+4价硫被A(填序号)氧化成SO42-.
A.O2 B.Ba2+ C.NO3-
(2)乙用如下实验对含+4价硫元素的物质性质继续进行探究.(均在敞口容器中)
| 序号 | 实验操作 | 实验现象 |
| 1 | 取0.3g 纯净Na2SO3固体,向其中加入10mL 2mol•L-1 盐酸,再滴入4滴BaCl2溶液 | 产生无色气泡;滴入BaCl2溶液后,开始无现象,4min后,溶液变浑浊 |
| 2 | 取0.3g 纯净Na2SO3固体,向其中加入10mL 2mol•L-1 HNO3,再滴入4滴BaCl2溶液 | 产生无色气泡;滴入BaCl2溶液后,开始无现象,2h后,溶液变浑浊 |
| 3 | 取0.3g 纯净Na2SO3固体,向其中加入10mL 浓HNO3,再滴入4滴BaCl2溶液 | 产生红棕色气体;滴入BaCl2溶液后,溶液立即产生大量白色沉淀 |
②由实验1、2、3对比,可以得到推论:含+4价硫元素物质可被O2和浓HNO3氧化.
③乙通过查阅资料发现:Na+对实验1和2中出现浑.浊的时间无影响,于是进一步探究Cl-和NO3-对其的影响:
| 序号 | 实验操作 | 实验现象 |
| 4 | 取0.3g纯净Na2SO3和1.17gNaCl固体混合物,向其中加入10mL 2mol•L-1 HNO3,再滴入4滴BaCl2溶液 | 产生无色气泡;滴入BaCl2溶液后,开始无现象,20min后,溶液变浑浊 |
ii.实验1和4对比,乙获得推论:NO3-的存在可以减慢溶液中+4价硫元素的氧化.
④通过以上实验,可以推测B装置最有可能的作用是吸收+6价硫的化合物.
13.在空气中N2所占的体积分数a,质量分数为b,则空气的平均相对分子质量为( )
| A. | 28b/a | B. | 29a/b | C. | ab/28 | D. | 28a/b |
10.下列叙述中正确的是( )
| A. | 25℃,Cu(OH)2 在水中的溶度积比其在 Cu(NO3)2 溶液中的大 | |
| B. | 一定温度下,将 0.10 mol/L的氨水加水稀释,溶液中各离子浓度均减小 | |
| C. | H3PO2 属于一元弱酸,则 H3PO2 与过量 NaOH 溶液反应的离子方程式为:H3PO2+3OH?═PO23-+3H2O | |
| D. | 常温下,NaHS 溶液中:c(H+)+c(H2S)═c(S2-)+c(OH-) |
6.除去下列物质中所含少量杂质(括号内为杂质),所选用的试剂和分离方法能达到实验目的是( )
| 混合物 | 试剂 | 分离方法 | |
| A | 苯(苯酚) | 溴水 | 过滤 |
| B | 乙烷(乙烯) | 氢气 | 加热 |
| C | 乙酸乙酯(乙酸) | NaOH溶液 | 蒸馏 |
| D | 淀粉(氯化钠) | 蒸馏水 | 渗析 |
| A. | A | B. | B | C. | C | D. | D |
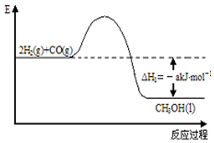 能源是人类生存和发展的重要支柱.研究并有效地开发新能源在能源紧缺的今天具有重要的理论意义.已知H2与CO反应生成CH3OH的过程如图所示:CO的燃烧热△H2=-b kJ•mol-1,CH3OH的燃烧热
能源是人类生存和发展的重要支柱.研究并有效地开发新能源在能源紧缺的今天具有重要的理论意义.已知H2与CO反应生成CH3OH的过程如图所示:CO的燃烧热△H2=-b kJ•mol-1,CH3OH的燃烧热 .
.