题目内容
10.下列叙述中正确的是( )| A. | 25℃,Cu(OH)2 在水中的溶度积比其在 Cu(NO3)2 溶液中的大 | |
| B. | 一定温度下,将 0.10 mol/L的氨水加水稀释,溶液中各离子浓度均减小 | |
| C. | H3PO2 属于一元弱酸,则 H3PO2 与过量 NaOH 溶液反应的离子方程式为:H3PO2+3OH?═PO23-+3H2O | |
| D. | 常温下,NaHS 溶液中:c(H+)+c(H2S)═c(S2-)+c(OH-) |
分析 A.Ksp与温度有关;
B.加水稀释促进一水合氨电离,氢氧根离子浓度减小,Ka不变;
C.H3PO2 属于一元弱酸,与NaOH以1:1反应;
D.NaHS 溶液中,由物料守恒可知c(Na+)=c(S2-)+c(HS-)+c(H2S),由电荷守恒可知,c(H+)+c(Na+)=c(S2-)+c(OH-)+c(HS-).
解答 解:A.Ksp与温度有关,则25℃,Cu(OH)2 在水中的溶度积与其在 Cu(NO3)2 溶液中溶度积相同,故A错误;
B.加水稀释促进一水合氨电离,氢氧根离子浓度减小,Ka不变,则c(H+)增大,故B错误;
C.H3PO2 属于一元弱酸,与NaOH以1:1反应,则H3PO2 与过量 NaOH 溶液反应的离子方程式为H3PO2+OH?═H2PO2-+H2O,故C错误;
D.NaHS 溶液中,由物料守恒可知c(Na+)=c(S2-)+c(HS-)+c(H2S),由电荷守恒可知,c(H+)+c(Na+)=c(S2-)+c(OH-)+c(HS-),则c(H+)+c(H2S)═c(S2-)+c(OH-),故D正确;
故选D.
点评 本题考查难溶电解质的溶解平衡及弱电解质的电离,为高频考点,把握电离平衡及Ka、Ksp的影响因素为解答的关键,侧重分析与应用能力的考查,注意选项B为易错点,题目难度不大.

练习册系列答案
相关题目
20.下列说法正确的是( )
| A. | 蒸发皿加热时均需要垫上石棉网 | |
| B. | 分液漏斗使用前均需要检查是否漏水 | |
| C. | 配制1 mol•L-1NaCl溶液、测定Na2CO3溶液的pH、焰色反应实验均需要用到玻璃棒 | |
| D. | 氯水存放在配有磨口塞的广口瓶中 |
1.设NA表示阿伏伽德罗常数,正确的是( )
| A. | 20°C时,28g N2所含的原子数为2NA个 | |
| B. | 标况下,0.5NA个水分子所占体积约为11.2L | |
| C. | CH4的摩尔质量在数值上等于NA个甲烷分子的质量之和 | |
| D. | 1gCO与1gCO2所含碳原子数之比是1:1 |
15.兵马俑中所用颜料成分一直是个谜,近年来科学家才得知大多为硅酸盐,如蓝紫色的硅酸铜钡(BaCuSi2Ox,铜为+2价),下列关于硅酸铜钡的说法错误的是( )
| A. | x等于6 | |
| B. | 性质稳定,不易脱色 | |
| C. | 易溶解于强酸和强碱 | |
| D. | 可用氧化物形式表示为BaO•CuO•2SiO2 |
2.下列离子方程式与所述事实相符的是( )
| A. | Na2S2O3溶液中加入稀盐酸:2S2O32-+2H+=SO42-+3S+H2O | |
| B. | 将少量SO2气体通入NaClO溶液中:SO2+H2O+2ClO-=SO32-+2HClO | |
| C. | 向含有0.4molFeBr2的溶液中通入0.3molCl2充分反应4Fe2++2Br-+3Cl2=4Fe3++6Cl-+Br2 | |
| D. | 向Al2(SO4)3溶液中加入过量氨水:Al3++4NH3•H2O=AlO2-+4NH4+ |
19.下列说法正确的是( )
| A. | 由原子构成的晶体不一定是原子晶体 | |
| B. | 分子晶体中的分子间可能含有共价键 | |
| C. | 分子晶体中一定有共价键 | |
| D. | 分子晶体中分子一定紧密堆积 |
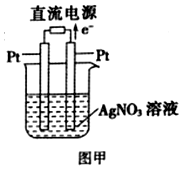 (1)常温下,0.5mol甲醇在氧气中充全燃烧生成CO2和液态水,放出热量363.3kJ.写 出甲醇燃烧的热化学方程式CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-726.6kJ•mol-1.
(1)常温下,0.5mol甲醇在氧气中充全燃烧生成CO2和液态水,放出热量363.3kJ.写 出甲醇燃烧的热化学方程式CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-726.6kJ•mol-1.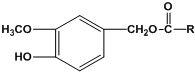 (R为烃基)
(R为烃基)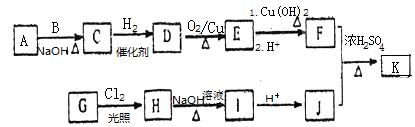
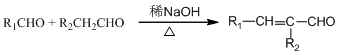
 ,
, ,
,
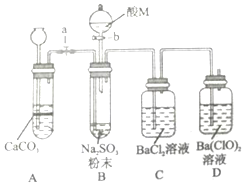 SO2是一种有毒气体,但可用于酒精的防腐剂,可以抵抗微生物的侵袭.甲同学用Na2SO4制备SO2,并验证SO2的部分性质.设计了如下实验步骤及装置:
SO2是一种有毒气体,但可用于酒精的防腐剂,可以抵抗微生物的侵袭.甲同学用Na2SO4制备SO2,并验证SO2的部分性质.设计了如下实验步骤及装置: