题目内容
18.A、B、C、D四种元素的原子序数均小于18,其最高正价依次为+1,+4,+5,+7.已知:B的原子核外次外层电子数为2;A、C的原子核外次外层电子数均为8;D元素的最高价氧化物对应的水化物在同一周期元素中酸性最强.则:(1)A、B、C、D分别是:Na、C、P、Cl.
(2)D离子结构示意图为
 .
.(3)C的最高价氧化物与A的氢氧化物反应可生成2种酸式盐,其化学式分别为NaH2PO4、Na2HPO4.
分析 A、B、C、D四种元素的原子序数均小于18,B的原子核外次外层电子数为2,即B原子核外有2个电子层,最高正化合价为+4,故B为碳元素;A、C原子的核外次外层电子数为8,均处于第三周期,最高正化合价依次为+1、+5,故A为Na、C为P元素;D元素最高价为+7,D元素的最高价氧化物对应的水化物在同一周期元素中酸性最强,则D为Cl,据此进行解答.
解答 解:A、B、C、D四种元素的原子序数均小于18,B的原子核外次外层电子数为2,即B原子核外有2个电子层,最高正化合价为+4,故B为碳元素;A、C原子的核外次外层电子数为8,均处于第三周期,最高正化合价依次为+1、+5,故A为Na、C为P元素;D元素最高价为+7,D元素的最高价氧化物对应的水化物在同一周期元素中酸性最强,则D为Cl,
(1)由上述分析可知,A、B、C、D的名称分别是Na、C、P、Cl,
故答案为:Na;C;P;Cl;
(2)D为Cl元素,则氯离子的质子数为17,有3个电子层,最外层电子数为8,其离子结构示意图为: ,
,
故答案为: ;
;
(3)C的最高价氧化物对应的水化物为H3PO4,与NaOH反应可以生成Na3PO4、NaH2PO4、Na2HPO43种盐,酸式盐为NaH2PO4、Na2HPO4,总共有2种酸式盐,
故答案为:2;NaH2PO4、Na2HPO4.
点评 本题考查了原子结构与元素周期律的关系,题目难度中等,正确推断元素为解答关键,注意熟练掌握原子结构与元素周期律、元素周期表的关系,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
8.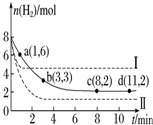 将6mol CO2和8mol H2充入一容积为2L的密闭容器中(温度保持不变)发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0测得H2的物质的量随时间变化如右图中实线所示(图中字母后的数字表示对应的坐标).该反应在8~10min内CO2的平均反应速率是( )
将6mol CO2和8mol H2充入一容积为2L的密闭容器中(温度保持不变)发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0测得H2的物质的量随时间变化如右图中实线所示(图中字母后的数字表示对应的坐标).该反应在8~10min内CO2的平均反应速率是( )
 将6mol CO2和8mol H2充入一容积为2L的密闭容器中(温度保持不变)发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0测得H2的物质的量随时间变化如右图中实线所示(图中字母后的数字表示对应的坐标).该反应在8~10min内CO2的平均反应速率是( )
将6mol CO2和8mol H2充入一容积为2L的密闭容器中(温度保持不变)发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0测得H2的物质的量随时间变化如右图中实线所示(图中字母后的数字表示对应的坐标).该反应在8~10min内CO2的平均反应速率是( )| A. | 0.5mol•L-1•min-1. | B. | 0.1mol•L-1•min-1 | ||
| C. | 0 mol•L-1•min-1 | D. | 0.125mol•L-1•min-1 |
9.下列括号中的物质是去除杂质所用的试剂,其中错误的是( )
| A. | CaO中有少量CaCO3(盐酸) | |
| B. | 氢气中含有少量氯化氢(苛性钠溶液) | |
| C. | 硫酸亚铁溶液中含有少量硫酸铜(铁粉) | |
| D. | CO2中有少量CO(灼热的氧化铜) |
6.已知某有机物含有4个C,每个碳原子都以键长相等的三条单键连接3个C,且整个结构中所有碳碳键之间的夹角都为60°,则下列说法不正确的是( )
| A. | 该有机物不存在 | B. | 该有机物的分子式为C4H4 | ||
| C. | 该有机物的空间构型为正四面体 | D. | 该有机物不属于笨的同系物 |
10.下列原子间一定形成共价键的是( )
| A. | 两个非金属元素的原子 | B. | 同周期元素的原子 | ||
| C. | 同主族元素的原子 | D. | 活泼金属与活泼非金属的原子 |
 .
.
 如图所示的装置为铁的吸氧腐蚀实验.一段时间后,向插入铁钉的玻璃筒内滴入K3[Fe(CN)6]溶液,可观察到现象为铁钉附近的溶液有蓝色沉淀,该反应的离子方程式为Fe2++[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓; 向插入碳棒的玻璃筒内滴入酚酞溶液,可观察到碳棒附近的溶液变红,该电极反应为O2+4e-+2H2O=4OH.
如图所示的装置为铁的吸氧腐蚀实验.一段时间后,向插入铁钉的玻璃筒内滴入K3[Fe(CN)6]溶液,可观察到现象为铁钉附近的溶液有蓝色沉淀,该反应的离子方程式为Fe2++[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓; 向插入碳棒的玻璃筒内滴入酚酞溶液,可观察到碳棒附近的溶液变红,该电极反应为O2+4e-+2H2O=4OH.