题目内容
8.设NA为阿伏加德罗常数的值,下列说法不正确的是( )| A. | 工业可采用火法炼铜:Cu2S+O2═2Cu+SO2 每生成2mol铜,反应共转移6NA个电子 | |
| B. | 标准状况下,11.2L甲苯含有的分子数为0.5NA | |
| C. | 20g重水(D2O)所含的电子数为10NA | |
| D. | 60gSiO2中共用电子对数目为4NA |
分析 A.该反应中Cu元素化合价由0价变为+1价,O元素化合价由0价变为-2价、S元素化合价由-2价变为+4价,根据化合价变化计算转移电子数;
B.标准状况下,甲苯为液体;
C.依据n=$\frac{m}{M}$计算物质的量结合分子式计算电子数;
D.二氧化硅中含有4个Si一0键.
解答 解:A.该反应中Cu元素化合价由0价变为+1价,O元素化合价由0价变为-2价、S元素化合价由-2价变为+4价,每生成2mol铜,有1molCu2S参加反应,反应共转移电子数=1mol×(4+2)×NA/mol=6NA,故A正确;
B.标准状况下,甲苯为液体,不能利用体积计算其物质的量,故B错误;
C.20g重水物质的量=$\frac{20g}{20g/mol}$=1mol,所含的电子数为10NA,故C正确;
D.60g SiO2晶体中含有4NA个Si一0键,共用电子对数目为4NA,故D正确.
故选B.
点评 本题考查阿伏加德罗常数的相关计算,题目难度不大,注意物质的组成、结构、性质以及物质存在的外界条件和聚集状态等问题.

练习册系列答案
相关题目
19.W、X、Y是原子序数依次增大的同一短周期元素.W、X是金属元素,它们的最高价氧化物的水化物之间可以反应生成盐和水;Y的最外层电子数是核外电子层数的2倍,W与Y可形成化合物W2Y.下列说法不正确的是( )
| A. | 原子半径W>X>Y | B. | W2Y的电子式为: | ||
| C. | 元素的金属性W<X | D. | W2Y2中既有离子键,又有共价键 |
16. 利用下图装置测定中和热的实验步骤如下:
利用下图装置测定中和热的实验步骤如下:
①用量筒量取50mL 0.5mol/L盐酸倒入小烧杯中,测出盐酸溶液温度;
②用另一量筒量取50mL 0.55mol/L NaOH溶液,并测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度.
回答下列问题:
(1)写出稀盐酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热为-57.3kJ/mol):$\frac{1}{2}$H2SO4(aq)+NaOH(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol
(2)倒入NaOH溶液的正确操作是E(从下列选出).C
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(3)使盐酸与NaOH溶液混合均匀的正确操作是(从下列选出).D
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃棒轻轻地搅动
(4)实验数据如表:①请填写下表中的空白:
②近似认为0.55mol/L NaOH溶液和0.5mol/L盐酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g•℃).则中和热△H=-56.8kJ/mol( 取小数点后一位).
 利用下图装置测定中和热的实验步骤如下:
利用下图装置测定中和热的实验步骤如下:①用量筒量取50mL 0.5mol/L盐酸倒入小烧杯中,测出盐酸溶液温度;
②用另一量筒量取50mL 0.55mol/L NaOH溶液,并测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度.
回答下列问题:
(1)写出稀盐酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热为-57.3kJ/mol):$\frac{1}{2}$H2SO4(aq)+NaOH(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol
(2)倒入NaOH溶液的正确操作是E(从下列选出).C
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(3)使盐酸与NaOH溶液混合均匀的正确操作是(从下列选出).D
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃棒轻轻地搅动
(4)实验数据如表:①请填写下表中的空白:
| 温度 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| HCl | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | |
| 2 | 27.0 | 27.4 | 27.2 | 32.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 | |
3.已知Br2+2Fe2+═2Br -+2Fe3+,现向含溶质a mol的FeBr2溶液中通入b mol Cl2,充分反应.下列说法不正确的是( )
| A. | 离子的还原性强弱:Fe2+>Br->Cl- | |
| B. | 当氯气少量时,发生的离子反应:2Fe2++Cl2═2Fe3++2Cl- | |
| C. | 当a=b时,反应后溶液的离子浓度:c(Fe3+):c(Br-):c(Cl-)=1:2:2 | |
| D. | 当氯气过量时,发生离子反应:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- |
13.由乙烯和苯推侧苯乙烯的结构或性质正确的是( )
| A. | 1 mol苯乙烯可以和4mol Br2发生加成反应 | |
| B. | 分子中所有原子可以在同一平面内 | |
| C. | 与HCl加成只生成一种产物 | |
| D. | 能使酸性KMnO4溶液褪色 |
20.以下关于化学实验中“先”与“后”的说法正确的是( )
①加热试管时,先均匀加热,后局部加热
②做H2还原CuO实验时,先通H2,后加热CuO,反应完毕后,先撤酒精灯待试管冷却,后停止通H2
③制取气体时,先检查装置气密性,后装药品
④点燃可燃性气体如H2、CO等时,先检验气体纯度,后点燃.
①加热试管时,先均匀加热,后局部加热
②做H2还原CuO实验时,先通H2,后加热CuO,反应完毕后,先撤酒精灯待试管冷却,后停止通H2
③制取气体时,先检查装置气密性,后装药品
④点燃可燃性气体如H2、CO等时,先检验气体纯度,后点燃.
| A. | ①② | B. | ①②③ | C. | ②③④ | D. | 全部 |
17.在蒸发皿中加热蒸干再灼烧下列物质的溶液,可以得到该物质固体的是( )
| A. | 氯化铝 | B. | 碳酸氢钠 | C. | 氯化亚铁 | D. | 硫酸铜 |
18.下列关于胶体的认识错误的是( )
| A. | 江河入海口三角洲的形成通常与胶体的性质有关 | |
| B. | 往Fe(OH)3胶体中逐滴加入稀硫酸会产生沉淀而后沉淀逐渐溶解 | |
| C. | 纳米材料粒子直径一般从几纳米到几十纳米,因此纳米材料属于胶体 | |
| D. | 水泥厂、冶金厂常用高压电除去烟尘,是因为烟尘粒子带电荷 |
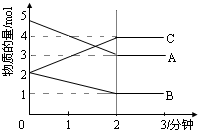 某温度时,在1L密闭容器中,A、B、C三种气态物质的物质的量随时间变化的曲线如图所示.由图中数据分析:
某温度时,在1L密闭容器中,A、B、C三种气态物质的物质的量随时间变化的曲线如图所示.由图中数据分析: