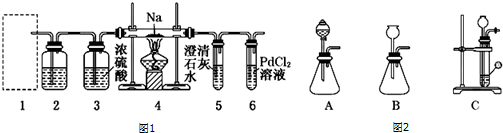
题目内容
11.下列离子方程式书写正确的是( )| A. | 碳酸钙与盐酸反应 CO32-+2H+=CO2↑+H2O | |
| B. | 铁钉放入硫酸铜溶液中 Fe+3Cu2+=2Fe3++3Cu | |
| C. | 氢氧化铜和硫酸反应 OH-+H+=H2O | |
| D. | 硫酸和氯化钡溶液反应 Ba2++SO42-=BaSO4↓ |
分析 A.碳酸钙在离子反应中保留化学式;
B.反应生成硫酸亚铁和Cu;
C.氢氧化铜在离子反应中保留化学式;
D.反应生成硫酸钡和盐酸.
解答 解:A.碳酸钙与盐酸反应的离子反应为CaCO3+2H+=Ca2=+CO2↑+H2O,故A错误;
B.铁钉放入硫酸铜溶液中的离子反应为Fe+Cu2+=Fe2++Cu,故B错误;
C.氢氧化铜和硫酸反应的离子反应为Cu(OH)2+2H+=Cu2++2H2O,故C错误;
D.硫酸和氯化钡溶液反应的离子反应为Ba2++SO42-=BaSO4↓,故D正确;
故选D.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意离子反应中保留化学式的物质,题目难度不大.

练习册系列答案
相关题目
6.下列哪一个分子模型不属于比例模型( )
| A. | 甲烷分子  | B. | 乙醇分子  | C. | 苯分子  | D. | 乙烯分子  |
6.已知氯气的漂白作用实际上是氯气与水反应生成的次氯酸的漂白作用.为了探究二氧化硫的漂白作用到底是二氧化硫本身还是二氧化硫与水作用的产物,某学习小组设计了如下装置来进行实验.请回答相关问题.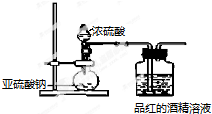
(1)为了探究干燥的SO2能不能使品红褪色,某同学设计了如右图所示实验装置,请指出实验装置图设计中的不合理之处.
①二氧化硫没有干燥(或缺少二氧化硫的干燥装置);
②没有尾气吸收装置.
(2)按照修改后的装置,实验中控制二氧化硫以大约每秒3个气泡的速度通过品红的酒精溶液时,经过一小时后,品红仍不褪色.这说明品红褪色的原因不是二氧化硫直接导致.为此,SO2能使品红的水溶液褪色的可能微粒有H2SO3、HSO3-、SO3 2-.
(3)甲同学实验如下:取等量、相同浓度的品红水溶液于两支试管中,再分别加入少量亚硫酸钠固体和亚硫酸氢钠固体,两支试管中的品红都褪色,对此,他得出结论:使品红褪色的微粒是HSO${\;}_{3}^{-}$和SO${\;}_{3}^{2-}$,不是H2SO3.你认为他的结论是否正确不正确,其理由是因亚硫酸根离子和亚硫酸氢根离子都会水解生成亚硫酸.
(4)为了进一步探究,乙组同学做了如下实验:分别取相同浓度的品红水溶液各20mL.于两只小烧杯中,两只烧杯中同时一次性各加入 20mL 0.1mol/L的亚硫酸钠,20mL 0.1mol/L的亚硫酸氢钠溶液,发现加入亚硫酸钠溶液的品红褪色较快.
①微粒浓度与褪色快慢关系,请用“多”或“少”填写“此空删去”内容..
②根据实验和分析,该同学得出的结论是主要是SO32-有漂白作用.

(1)为了探究干燥的SO2能不能使品红褪色,某同学设计了如右图所示实验装置,请指出实验装置图设计中的不合理之处.
①二氧化硫没有干燥(或缺少二氧化硫的干燥装置);
②没有尾气吸收装置.
(2)按照修改后的装置,实验中控制二氧化硫以大约每秒3个气泡的速度通过品红的酒精溶液时,经过一小时后,品红仍不褪色.这说明品红褪色的原因不是二氧化硫直接导致.为此,SO2能使品红的水溶液褪色的可能微粒有H2SO3、HSO3-、SO3 2-.
(3)甲同学实验如下:取等量、相同浓度的品红水溶液于两支试管中,再分别加入少量亚硫酸钠固体和亚硫酸氢钠固体,两支试管中的品红都褪色,对此,他得出结论:使品红褪色的微粒是HSO${\;}_{3}^{-}$和SO${\;}_{3}^{2-}$,不是H2SO3.你认为他的结论是否正确不正确,其理由是因亚硫酸根离子和亚硫酸氢根离子都会水解生成亚硫酸.
(4)为了进一步探究,乙组同学做了如下实验:分别取相同浓度的品红水溶液各20mL.于两只小烧杯中,两只烧杯中同时一次性各加入 20mL 0.1mol/L的亚硫酸钠,20mL 0.1mol/L的亚硫酸氢钠溶液,发现加入亚硫酸钠溶液的品红褪色较快.
①微粒浓度与褪色快慢关系,请用“多”或“少”填写“此空删去”内容..
| 同浓度溶液 | SO${\;}_{3}^{2-}$ | HSO${\;}_{3}^{-}$ | H2SO3 | 褪色速度 |
| Na2SO3溶液 | 多 | 少 | 少 | 快 |
| NaHSO3溶液 | 较上面少 | 较上面多 | 较上面多 | 慢 |
3.将0.4mol体积比为1:1甲和乙两种混合气体同时通入50mL1mol•L-1的丙溶液中,无沉淀产生的是( )
| 序号 | 甲 | 乙 | 丙 |
| A | Cl2 | SO2 | Ba(NO3)2 |
| B | HCl | CO2 | 石灰水 |
| C | NH3 | SO2 | Ba(OH)2 |
| D | NO2 | SO2 | BaCl2 |
| A. | A | B. | B | C. | C | D. | D |
20.用下列实验装置完成对应的实验(部分仪器已省略),能达到实验目的是( )
| A. |  干燥Cl2 | B. |  分离乙醇和乙酸 | ||
| C. |  石油的蒸馏 | D. |  分离I2 |
1.下列说法不正确的是( )
| A. | 煤是复杂的混合物,含有苯、甲苯、二甲苯等一系列重要的化工原料 | |
| B. | 石油分馏得到的汽油、煤油、柴油等各种沸点范围不同的混合物 | |
| C. | 通过石油裂化和裂解可以获得轻质油和重要化工原料(乙烯、丙烯等) | |
| D. | 天然气和沼气的主要成分是甲烷,它们都属于不可再生能源 |