题目内容
回答下列问题

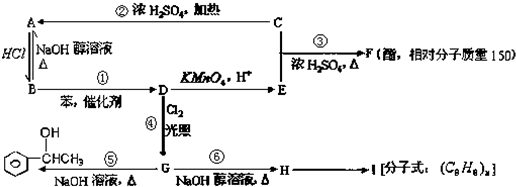
(1)如图1元素③、④形成的氢化物熔沸点高的是 (用氢化物的化学式表示),原因是 .用反应方程式证明③、⑤的非金属性强弱 .
(2)A、B两种化合物均由①②③④四种元素组成,写出此两种化合物在水溶液中发生反应的离子方程式 .
(3)④单质在空气中燃烧生成X,已知一定条件下16gX被氧气氧化放出24.5KJ热量,写出X被氧化的热化学反应方程式 .
(4)如图1装置B中有关反应的化学方程式为 .将②、③两元素形成的含非极性共价键的化合物投入氯化亚铁溶液中,会立即观察到红褐色沉淀,同时有无色气泡.写出红褐色沉淀与气体是2:1时的离子方程式 .

(1)如图1元素③、④形成的氢化物熔沸点高的是
(2)A、B两种化合物均由①②③④四种元素组成,写出此两种化合物在水溶液中发生反应的离子方程式
(3)④单质在空气中燃烧生成X,已知一定条件下16gX被氧气氧化放出24.5KJ热量,写出X被氧化的热化学反应方程式
(4)如图1装置B中有关反应的化学方程式为
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:(1)元素③、④分别为O、S元素,水中水分子间存在氢键,熔沸点升高;F的非金属性比O强,F可以从水中置换出O;
(2)①②③④四种元素分别为H、O、Na、S,这4种元素能够形成的化合物有硫酸氢钠和亚硫酸氢钠两种;
(3)S在空气中燃烧生成二氧化硫,16g二氧化硫催化氧化生成三氧化硫时放热24.5KJ,据此书写热化学方程式;
(4)据图中药品和装置分析,A中为水,反应是铁与水蒸气的反应;②、③两元素为O与Na,其形成的含非极性共价键的化合物为Na2O2,其投入氯化亚铁溶液中生成氢氧化铁沉淀和氧气,据此分析.
(2)①②③④四种元素分别为H、O、Na、S,这4种元素能够形成的化合物有硫酸氢钠和亚硫酸氢钠两种;
(3)S在空气中燃烧生成二氧化硫,16g二氧化硫催化氧化生成三氧化硫时放热24.5KJ,据此书写热化学方程式;
(4)据图中药品和装置分析,A中为水,反应是铁与水蒸气的反应;②、③两元素为O与Na,其形成的含非极性共价键的化合物为Na2O2,其投入氯化亚铁溶液中生成氢氧化铁沉淀和氧气,据此分析.
解答:
解:(1)元素③、④分别为O、S元素,水中水分子间存在氢键,熔沸点升高;F的非金属性比O强,F可以从水中置换出O,故答案为:H2O;水分子间存在氢键;2F2+2H2O=4HF+O2;
(2)①②③④四种元素分别为H、O、Na、S,这4种元素能够形成的化合物有硫酸氢钠和亚硫酸氢钠两种,硫酸氢钠可以与亚硫酸氢钠反应生成二氧化硫气体,反应的离子方程式为:HSO3-+H+=SO2↑+H2O,故答案为:HSO3-+H+=SO2↑+H2O;
(3)S在空气中燃烧生成二氧化硫,16g二氧化硫催化氧化生成三氧化硫时放热24.5KJ,则2mol二氧化硫反应放热:2mol×64g/mol×24.5KJ÷16g=196KJ,所以其热化学方程式为:2SO2(g)+O2(g)?2SO3(g)△H=-196kJ/mol,故答案为:2SO2(g)+O2(g)?2SO3(g);△H=-196kJ/mol;
(4)据图中药品和装置分析,A中为水,反应是铁与水蒸气的反应,化学方程式为:3Fe+4H2O(g)=Fe3O4+4H2,两元素为O与Na,其形成的含非极性共价键的化合物为Na2O2,其投入氯化亚铁溶液中生成氢氧化铁沉淀和氧气,据生成氢氧化铁与氧气物质的量之比是2:1,写出离子方程式为:2Fe2++3Na2O2+4H2O=2Fe(OH)3↓+O2↑+6Na++2OH -,故答案为:3Fe+4H2O(g)=Fe3O4+4H2;2Fe2++3Na2O2+4H2O=2Fe(OH)3↓+O2↑+6Na++2OH -.
(2)①②③④四种元素分别为H、O、Na、S,这4种元素能够形成的化合物有硫酸氢钠和亚硫酸氢钠两种,硫酸氢钠可以与亚硫酸氢钠反应生成二氧化硫气体,反应的离子方程式为:HSO3-+H+=SO2↑+H2O,故答案为:HSO3-+H+=SO2↑+H2O;
(3)S在空气中燃烧生成二氧化硫,16g二氧化硫催化氧化生成三氧化硫时放热24.5KJ,则2mol二氧化硫反应放热:2mol×64g/mol×24.5KJ÷16g=196KJ,所以其热化学方程式为:2SO2(g)+O2(g)?2SO3(g)△H=-196kJ/mol,故答案为:2SO2(g)+O2(g)?2SO3(g);△H=-196kJ/mol;
(4)据图中药品和装置分析,A中为水,反应是铁与水蒸气的反应,化学方程式为:3Fe+4H2O(g)=Fe3O4+4H2,两元素为O与Na,其形成的含非极性共价键的化合物为Na2O2,其投入氯化亚铁溶液中生成氢氧化铁沉淀和氧气,据生成氢氧化铁与氧气物质的量之比是2:1,写出离子方程式为:2Fe2++3Na2O2+4H2O=2Fe(OH)3↓+O2↑+6Na++2OH -,故答案为:3Fe+4H2O(g)=Fe3O4+4H2;2Fe2++3Na2O2+4H2O=2Fe(OH)3↓+O2↑+6Na++2OH -.
点评:本题考查据元素周期表的结构判断元素种类以及元素及其化合物的性质,氧化还原反应方程式书写,题目难度较大.

练习册系列答案
相关题目
下列氢化物的性质按顺序排列正确的是( )
| A、HI、HBr、HCl、HF(酸性减弱) |
| B、HCl、H2S、PH3、SiH4(稳定性减弱) |
| C、H2O、H2S、HCl、HBr(还原性增强) |
| D、HF、H2O、PH3、NH3 (稳定性减弱) |
下列实验操作正确的是( )
| A、过滤时,漏斗的下端应紧贴烧杯内壁 |
| B、给试管中的液体加热时,可以用手直接拿试管 |
| C、给试管中的固体加热时,试管口应略向上倾斜 |
| D、蒸馏液体时,冷水应从冷凝管的上端进入,下端出 |
下列物品的盛放错误的是( )
| A、过氧化钾固体必须密封保存 |
| B、烧碱必须密封保存 |
| C、碱金属必须保持在煤油中 |
| D、氢氧化钠溶液用带玻璃塞的玻璃瓶存放 |