题目内容
2.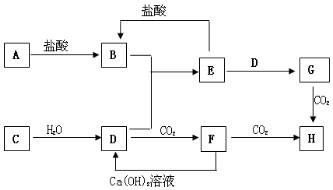 如图,图中A~H均为中学化学中常见的物质,它们之间有如下转化关系.其中A、C均为金属单质,C与水反应生成D和最轻的气体,D、H的焰色反应均呈黄色,在通常状况下E(氢氧化物)跟NaOH或盐酸均可发生复分解反应.(反应过程中生成的水及其他产物已略去)
如图,图中A~H均为中学化学中常见的物质,它们之间有如下转化关系.其中A、C均为金属单质,C与水反应生成D和最轻的气体,D、H的焰色反应均呈黄色,在通常状况下E(氢氧化物)跟NaOH或盐酸均可发生复分解反应.(反应过程中生成的水及其他产物已略去)请回答以下问题:
(1)A的原子结构示意图
 ;F是Na2CO3.(填化学式)
;F是Na2CO3.(填化学式)(2)请写出反应C→D的化学方程式,并用单线桥法或双线桥法标明该反应中电子转移的方向和数目:
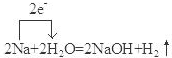 .
.(3)写出E转化为G的离子方程式Al(OH)3+OH-═AlO2-+2H2O.
分析 H的焰色反应呈黄色,说明H中有钠元素,C均为金属单质,C与水反应生成D,D与二氧化碳生成F,F再与二氧化碳反应生成H,且F与氢氧化钙生成D,可推知,C为Na,D为NaOH,F为Na2CO3,H为NaHCO3,在通常状况下E跟NaOH或盐酸均可以发生反应,E应为两性物质,根据G与二氧化碳生成H,且B和D可生成E,可推知E为Al(OH)3,G为NaAlO2,B为AlCl3 ,单质A为Al,以此解答该题.
解答 解:(1)由以上分析可知A为Al,原子结构示意图为 ,F为Na2CO3,故答案为:
,F为Na2CO3,故答案为: ;Na2CO3;
;Na2CO3;
(2)反应C→D是钠与水反应生成氢氧化钠与氢气,标出电子转移的方向和数目: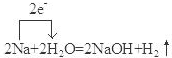 ,
,
故答案为: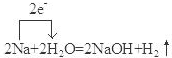 ;
;
(3)E转化为G的离子方程式:Al(OH)3+OH-═AlO2-+2H2O,
故答案为:Al(OH)3+OH-═AlO2-+2H2O.
点评 本题考查无机物的推断,为高频考点,利用H、E性质结合各物质转化关系进行推断为解答本题的关键,题目难度中等,答题时注意元素化合物知识的灵活运用.

练习册系列答案
 金钥匙试卷系列答案
金钥匙试卷系列答案
相关题目
13.X、Y、Z、W为四种短周期主族元素,它们在周期表中的位置如图所示.W元素的简单离子半径在同周期元素的简单离子中最小.下列说法中正确的是( )
| X | Y | ||
| Z | W |
| A. | Y元素的气态氢化物易液化,是因为其分子间能形成氢键 | |
| B. | X元素最高价氧化物分子的比例模型为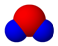 | |
| C. | Z单质与X元素最高价氧化物、Y单质都能反应,体现氧化性 | |
| D. | W的单质在地壳含量丰富,工业上可通过电解它的无水盐来制备 |
10.CsICl2是一种碱金属的化合物,这类物质在化学反应中既可表现氧化性又可表现还原性,有关该物质的说法正确的是( )
| A. | Cs显+3价,I、Cl均显-1价 | |
| B. | 在CsICl2溶液中通入SO2气体,有硫酸生成 | |
| C. | Cs显+1价,Cl显+1价,I显-3价 | |
| D. | 在CsICl2溶液中通入Cl2,有单质碘生成 |
17.下列有关氧化还原反应的叙述正确的是( )
| A. | 金属单质在反应中只作还原剂 | |
| B. | 非金属单质在反应中只作氧化剂 | |
| C. | 金属失电子越多,其还原性越强有力 | |
| D. | Cu2+比Fe2+氧化性强,Fe比Cu还原性强 |
14.光纤通讯是一种现代化的通讯手段,光纤通讯容量大,一对光纤上可同时传送3万门电 话的信号.制造光导纤维的主要原料是SiO2.下列关于SiO2的说法正确的是( )
| A. | SiO2摩尔质量是60 | |
| B. | 1 molSiO2中含有1 molO2 | |
| C. | 1.5 molSiO2中含有1.806×1024个氧原子 | |
| D. | 1 molSiO2质量是60 g•mol-1 |
11.碳和氮是动植物体中的重要组成元素,向大气中过度排放二氧化碳会造成温室效应,氮氧化物会产生光化学烟雾,目前,这些有毒有害气体的处理成为科学研究的重要内容.
(1)已知2.00g的C2H2完全燃烧生成液态水和二氧化碳气体放出99.6kJ热量,写出表示C2H2燃烧热的热化学方程式C2H2(g)+$\frac{5}{2}$O2(g)=2CO2(g)+H2O(l)△H=-1294.8 kJ/mol.
(2)利用上述反应设计燃料电池(电解质溶液为氢氧化钾溶液),写出电池负极的电极反应式C2H2-10e-+14OH-=2CO32-+8H2O.
(3)用活性炭还原法处理氮氧化物,有关反应为:C(s)+2NO(g)N2(g)+CO2(g).某研究小组向一个容器容积为3L且容积不变的密闭真空容器(固体试样体积忽略不计)中加入NO和足量的活性炭,在恒温(T1℃)条件下反应,测得不同时间(t)时各物质的物质的量(n)如表:
①10min~20min以v(NO)表示的反应速率为0.012mol/(L•min).
②下列各项能判断该反应达到平衡状态的是ACE(填序号字母).
A.v(NO)(正)=2v(N2)(逆) B.容器内CO2和N2的体积比为1:1
C.混合气体的平均相对分子质量保持不变 D.容器内压强保持不变
E.混合气体的密度保持不变
③一定温度下,随着NO的起始浓度增大,则NO的平衡转化率不变 (填“增大”、“不变”或“减小”).
(4)在3L容积可变的密闭容器中发生上述反应:H2(g)+CO2(g)H2O(g)+CO(g),恒温下c(CO)随反应时间t变化的曲线Ⅰ如图1所示.
①若在t0时改变一个条件,使曲线Ⅰ变成曲线Ⅱ,则改变的条件是加入催化剂;
②若在t0时刻将容器体积快速压缩至2L(其他条件不变),请在图1中画出c(CO)随反应时间t变化的曲线.
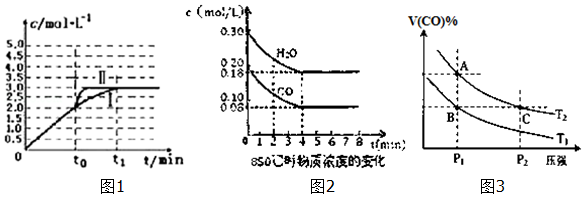
(5)已知:CO(g)+H2O(g)H2(g)+CO2(g)?H=-41.2kJ/mol,850℃时在一体积为10L的恒容密闭容器中,通入一定量的CO和H2O,CO和H2O浓度变化如图2所示:下列说法正确的是B(填序号)
A.达到平衡时,氢气的物质的量是0.12mol
B.达到平衡时,反应体系最终会放出49.44kJ热量
C.第6min时,若升高温度,反应正向移动
D.第8min时,若充入氦气,会导致v正(CO)<v逆(H2O)
(6)图3表示在温度分别为T1、T2时,平衡体系中CO的体积分数随压强变化曲线,A、C两点的反应速率A<C(填“>”、“=”或“<”,下同),由状态B到状态A,可采用升温的方法(填“升温”或“降温”).
(1)已知2.00g的C2H2完全燃烧生成液态水和二氧化碳气体放出99.6kJ热量,写出表示C2H2燃烧热的热化学方程式C2H2(g)+$\frac{5}{2}$O2(g)=2CO2(g)+H2O(l)△H=-1294.8 kJ/mol.
(2)利用上述反应设计燃料电池(电解质溶液为氢氧化钾溶液),写出电池负极的电极反应式C2H2-10e-+14OH-=2CO32-+8H2O.
(3)用活性炭还原法处理氮氧化物,有关反应为:C(s)+2NO(g)N2(g)+CO2(g).某研究小组向一个容器容积为3L且容积不变的密闭真空容器(固体试样体积忽略不计)中加入NO和足量的活性炭,在恒温(T1℃)条件下反应,测得不同时间(t)时各物质的物质的量(n)如表:
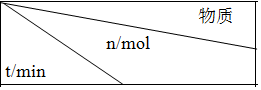 | NO | N2 | CO2 |
| 0 | 2.00 | 0 | 0 |
| 10 | 1.16 | 0.42 | 0.42 |
| 20 | 0.80 | 0.60 | 0.60 |
| 30 | 0.80 | 0.60 | 0.60 |
②下列各项能判断该反应达到平衡状态的是ACE(填序号字母).
A.v(NO)(正)=2v(N2)(逆) B.容器内CO2和N2的体积比为1:1
C.混合气体的平均相对分子质量保持不变 D.容器内压强保持不变
E.混合气体的密度保持不变
③一定温度下,随着NO的起始浓度增大,则NO的平衡转化率不变 (填“增大”、“不变”或“减小”).
(4)在3L容积可变的密闭容器中发生上述反应:H2(g)+CO2(g)H2O(g)+CO(g),恒温下c(CO)随反应时间t变化的曲线Ⅰ如图1所示.
①若在t0时改变一个条件,使曲线Ⅰ变成曲线Ⅱ,则改变的条件是加入催化剂;
②若在t0时刻将容器体积快速压缩至2L(其他条件不变),请在图1中画出c(CO)随反应时间t变化的曲线.
(5)已知:CO(g)+H2O(g)H2(g)+CO2(g)?H=-41.2kJ/mol,850℃时在一体积为10L的恒容密闭容器中,通入一定量的CO和H2O,CO和H2O浓度变化如图2所示:下列说法正确的是B(填序号)
A.达到平衡时,氢气的物质的量是0.12mol
B.达到平衡时,反应体系最终会放出49.44kJ热量
C.第6min时,若升高温度,反应正向移动
D.第8min时,若充入氦气,会导致v正(CO)<v逆(H2O)
(6)图3表示在温度分别为T1、T2时,平衡体系中CO的体积分数随压强变化曲线,A、C两点的反应速率A<C(填“>”、“=”或“<”,下同),由状态B到状态A,可采用升温的方法(填“升温”或“降温”).

12.按照初中化学的分类方法,下列反应既属于氧化反应又属于化合反应的是( )
| A. | NaHCO3+HCl═NaCl+H2O+CO2↑ | B. | 2KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$ 2KCl+2O2↑ | ||
| C. | S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2 | D. | 2CuO+C$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+CO2 |