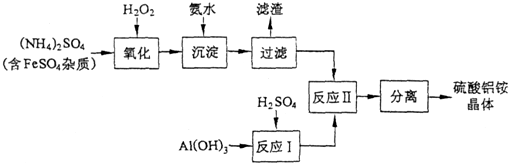
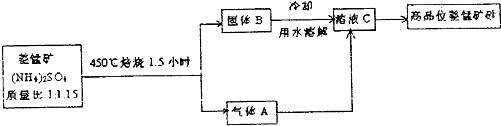
题目内容
A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的透明气球.关闭K2,将等量且少量的NO2通过K1、K3分别充入A、B中,反应起始时,A、B的体积相同.(已知:2NO2═N2O4△H<0)下列叙述正确的是( )
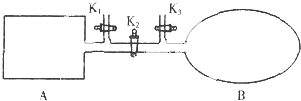

| A、到达平衡时A和B中NO2气体体积分数相同 |
| B、若在A、B中再充入与初始量相等的NO2,则达到平衡时A、B中NO2转化率都增大 |
| C、若气球的体积不再改变,表明B中反应已达到平衡 |
| D、室温下,若设法使A、B都保持体积不变,将A套上一个绝热层,B与外界可以进行热传递,则达到平衡时B中气体的颜色较深 |
考点:化学平衡的计算
专题:
分析:A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的透明气球.说明A为恒温恒容,B为恒温恒压,2NO2═N2O4 △H<0是一个气体体积减小、正反应为放热的反应,
A、反应2NO2═N2O4 气体体积减小,A相当于B为减小压强,平衡逆向移动,A中NO2气体体积分数大B中NO2气体体积分数;
B、保持容器容积不变,通入一定量的NO2,等效为增大压强到达的平衡,增大压强平衡向气体体积减小的方向移动,保持压强不变,通入一定量的NO2,平衡不移动;
C、反应2NO2═N2O4 气体体积减小,气球的体积不再改变,说明各组分的量不再变化;
D、该反应为放热反应,A套上一个绝热层,温度升高,平衡逆向移动,NO2的浓度增大,B仍为原平衡状态.
A、反应2NO2═N2O4 气体体积减小,A相当于B为减小压强,平衡逆向移动,A中NO2气体体积分数大B中NO2气体体积分数;
B、保持容器容积不变,通入一定量的NO2,等效为增大压强到达的平衡,增大压强平衡向气体体积减小的方向移动,保持压强不变,通入一定量的NO2,平衡不移动;
C、反应2NO2═N2O4 气体体积减小,气球的体积不再改变,说明各组分的量不再变化;
D、该反应为放热反应,A套上一个绝热层,温度升高,平衡逆向移动,NO2的浓度增大,B仍为原平衡状态.
解答:
解:A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的透明气球.说明A为恒温恒容,B为恒温恒压,反应2NO2═N2O4 △H<0是一个气体体积减小、正反应为放热的反应,
A、反应2NO2═N2O4 气体体积减小,A相当于B为减小压强,平衡逆向移动,A中NO2气体体积分数大B中NO2气体体积分数,故A错误;
B、保持容器容积不变,通入一定量的NO2,等效为增大压强到达的平衡,增大压强平衡向正反应方向移动,NO2的转化率将增大,保持压强不变,通通入一定量的NO2,平衡不移动,达到平衡时NO2的转化率不变,故B错误;
C、反应2NO2═N2O4 气体体积减小,气球的体积不再改变,说明各组分的量不再变化,反应达到平衡状态,故C正确;
D、该反应为放热反应,A套上一个绝热层,温度升高,平衡逆向移动,NO2的浓度增大,颜色变深,B仍为原平衡状态,NO2的浓度不变,颜色不变,故D错误.
故选:C.
A、反应2NO2═N2O4 气体体积减小,A相当于B为减小压强,平衡逆向移动,A中NO2气体体积分数大B中NO2气体体积分数,故A错误;
B、保持容器容积不变,通入一定量的NO2,等效为增大压强到达的平衡,增大压强平衡向正反应方向移动,NO2的转化率将增大,保持压强不变,通通入一定量的NO2,平衡不移动,达到平衡时NO2的转化率不变,故B错误;
C、反应2NO2═N2O4 气体体积减小,气球的体积不再改变,说明各组分的量不再变化,反应达到平衡状态,故C正确;
D、该反应为放热反应,A套上一个绝热层,温度升高,平衡逆向移动,NO2的浓度增大,颜色变深,B仍为原平衡状态,NO2的浓度不变,颜色不变,故D错误.
故选:C.
点评:本题考查压强、温度、浓度对化学平衡的影响,难度中等,构建平衡建立的等效途径是解题的关键.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案
相关题目
在密闭容器中,发生反应:xA(g)+yB(g)?zC(g).反应达到平衡时,A的浓度为0.5mol/L;若保持温度不变,将容器的容积扩大到原来的2倍,达到新平衡时A的浓度降为0.3mol/L.下列判断正确的是( )
| A、x+y<z |
| B、平衡向正反应方向移动 |
| C、B的转化率升高 |
| D、C的体积分数下降 |
由Fe2O3、Fe、CuO、C、Al中的几种物质组成的混合粉末,取样品进行下列实验(部分产物略去).关于混合粉末的组成判断正确的是( )


| A、一定含CuO和C |
| B、一定含Fe2O3、CuO和C |
| C、一定含CuO和C,一定不含Al |
| D、不管试剂a为H2O或饱和NaHCO3溶液,气体Z都为纯净物 |
下列实验装置一般不用于分离物质的是( )
A、 |
B、 |
C、 |
D、 |