题目内容
17.已知:①CaCO3(s)═CaO(s)+CO2(g)△H=+177.7kJ
②C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol
③CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283kJ/mol
④C(s)+H2O(s)═CO(g)+H2(g)△H=-131.3kJ/mol
⑤HNO3(aq)+NaOH(aq)═NaNO3(aq)+H2O(l)△H=-57.3kJ/mol
⑥$\frac{1}{2}$H2SO4(l)+NaOH(l)═$\frac{1}{2}$Na2SO4(l)+H2O(l)△H=-57.3kJ/mol
⑦2H2(g)+O2(g)═2H2O(l)△H=-517.6kJ/mol
(1)上述热化学方程式中,不正确的有④⑥,不正确的理由分别④中水的状态应为“g”,△H=+131.KJ/mol,⑥除H2O外其它物质的状态不是“l”应为“aq”;
(2)根据上述信息,写出C转化为CO的热化学方程式:C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-110.5KJ/mol;
(3)上述反应中,表示燃烧热的热化学方程式有②③,表示中和热的热化学方程式有⑤(填序号).
分析 (1)热化学方程式要标明物质的聚集状态,并且焓变的符号和单位要正确,根据热化学方程式的书写方法来回答;
(2)结合化学反应②③,利用盖斯定律来回答;
(3)物质燃烧伴随热量的释放的化学反应是物质燃烧热的热化学方程式,酸碱中和生成盐和水并伴随热量的释放的反应是中和热的热化学方程式.
解答 解:(1)根据热化学方程式的书写方法,④⑥都是有错误的,错误之处分别是:④中水的状态应为“g”,△H=+131.KJ/mol,⑥除H2O外其它物质的状态不是“l”应为“aq”;
故答案为:④⑥,④中水的状态应为“g”,△H=+131.KJ/mol,⑥除H2O外其它物质的状态不是“l”应为“aq”;
(2)结合化学反应②③,利用盖斯定律,反应C(s)+$\frac{1}{2}$O2(g)=CO(g)是②-③得来,所以焓变△H=-110.5KJ/mol,C转化为CO的热化学方程式C(s)+$\frac{1}{2}$O2(g)=CO(g);△H=-110.5KJ/mol,
故答案为:C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-110.5KJ/mol;
(3)上述反应中,②③分别是表示C、CO燃烧热的热化学方程式,⑤表示的是中和热的热化学方程式,故答案为:②③;⑤.
点评 本题考查学生热化学方程式的书写方法以及盖斯定律计算化学反应的焓变等知识,注意知识的归纳和整理是解题关键,难度不大.

练习册系列答案
 应用题作业本系列答案
应用题作业本系列答案
相关题目
8.已知某有机物A分子式为C5H10O2,且能与NaHCO3溶液反应产生气体,则A的同分异构体数目共有(不考虑立体结构)( )
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
9.下列选项括号中的物质是除去杂质所需要的药品,其中错误的是( )
| A. | NaCl中含有杂质Na2SO4(适量氯化钡) | |
| B. | FeSO4 中含有杂质CuSO4(铁粉) | |
| C. | SO2中含有少量HCl气体(氢氧化钠溶液) | |
| D. | CO2中含有少量的CO(灼热的氧化铜) |
6.Na的离子半径和Ne的原子半径( )
| A. | 大于 | B. | 小于 | C. | 等于 | D. | 不能肯定 |
7.三草酸合铁酸钾晶体K3[Fe(C2O4)3]?3H2O可用于摄影和蓝色印刷.某小组将无水三草酸合铁酸钾在一定条件下加热分解,对所得气体产物和固体产物进行实验和探究.请利用实验室常用仪器、用品和以下限选试剂完成验证和探究过程.
限选试剂:浓硫酸、1.0mol•L-1HNO3、1.0mol•L-1盐酸、1.0mol•L-1NaOH、3% H2O2、0.1mol•L-1 KI、0.1mol•L-1 CuSO4、20% KSCN、澄清石灰水、氧化铜、蒸馏水.
(1)该小组同学查阅资料后推知,固体产物中,铁元素不可能以三价形式存在,而盐只有K2CO3.验证固体产物中钾元素存在的方法是利用焰色反应,现象是透过蓝色钴玻璃,观察到紫色的火焰.
(2)固体产物中铁元素存在形式的探究.
①提出合理假设
假设1:全部是铁单质;
假设2:全部为FeO;
假设3:同时存在铁单质和FeO.
②设计实验方案证明你的假设
③实验过程
根据②中方案进行实验.在答题卡上按下表的格式写出实验步骤、预期现象与结论.
限选试剂:浓硫酸、1.0mol•L-1HNO3、1.0mol•L-1盐酸、1.0mol•L-1NaOH、3% H2O2、0.1mol•L-1 KI、0.1mol•L-1 CuSO4、20% KSCN、澄清石灰水、氧化铜、蒸馏水.
(1)该小组同学查阅资料后推知,固体产物中,铁元素不可能以三价形式存在,而盐只有K2CO3.验证固体产物中钾元素存在的方法是利用焰色反应,现象是透过蓝色钴玻璃,观察到紫色的火焰.
(2)固体产物中铁元素存在形式的探究.
①提出合理假设
假设1:全部是铁单质;
假设2:全部为FeO;
假设3:同时存在铁单质和FeO.
②设计实验方案证明你的假设
③实验过程
根据②中方案进行实验.在答题卡上按下表的格式写出实验步骤、预期现象与结论.
| 实验步骤 | 预期现象与结论 |
| 步骤1: | 部分固体不溶解 |
| 步骤2: | |
| 步骤3:继续步骤2中的(2),进行固液分离,用蒸馏水洗涤固体至洗涤液无色.取少量固体于试管中,滴加过量HCl后,静置,取上层清液,滴加适量H2O2,充分振荡后滴加KSCN. |

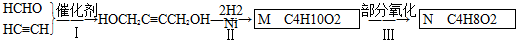
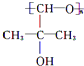

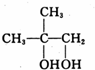 ,B中的官能团名称是醛基和醇羟基.
,B中的官能团名称是醛基和醇羟基.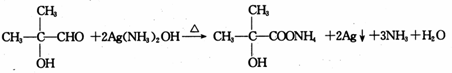 .
.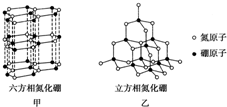 氮化硼(BN)晶体有多种相结构.六方相氮化硼是通常存在的稳定相,与石墨相似,只有层状结构,可作高温润滑剂.立方相氮化硼是超硬材料,有优异的耐磨性.它们的晶体结构如图所示.
氮化硼(BN)晶体有多种相结构.六方相氮化硼是通常存在的稳定相,与石墨相似,只有层状结构,可作高温润滑剂.立方相氮化硼是超硬材料,有优异的耐磨性.它们的晶体结构如图所示.