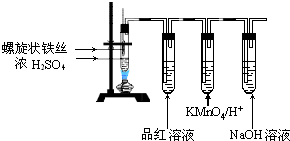
题目内容
5.某化工厂尝试用软锰矿、闪锌矿(含有Fe、Cu、Al等元素杂质)联合制备工业产品MnO2和Zn.(已知:软锰矿的主要成分为MnO2,闪锌矿主要成分为ZnS.)
(1)原料需加工成矿粉的原因是增大反应接触面积,加快反应速率.
(2)已知MnO2有较强的氧化性,在酸性溶液中能氧化金属硫化物生成硫单质,请写出原料矿粉加稀硫酸后所发生的主要反应MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S+2H2O.
(3)酸浸液(Ⅰ)中含有的金属阳离子有Mn2+、Fe3+、Zn2+、Cu2+、Al3+.
(4)酸性溶液(Ⅱ)中加入适量MnO2的作用是将Fe2+氧化成Fe3+;酸性溶液(Ⅲ)中所加的碳酸盐可选用②③(填序号).
①Na2CO3 ②MnCO3 ③ZnCO3 ④CaCO3
(5)电解溶液Ⅳ后阳极产物为MnO2,若电解过程转移1mol电子,则理论上阴极产物的质量为32.5g.
分析 矿粉中加入稀硫酸酸浸,含有的金属阳离子有Mn2+、Fe3+、Zn2+、Cu2+、Al3+等,加入适量锌粉,锌可置换出铜,沉淀物中含有铜等,酸性溶液Ⅱ中加入适量的二氧化锰,可将Fe2+氧化成Fe3+,然后加入碳酸盐调节溶液的pH,可促进铁离子、铝离子的水解,可生成氢氧化铁、氢氧化铝沉淀,溶液Ⅳ中含有Mn2+、Zn2+,电解,可生成MnO2和Zn.以此解答该题.
解答 解:矿粉中加入稀硫酸酸浸,含有的金属阳离子有Mn2+、Fe3+、Zn2+、Cu2+、Al3+等,加入适量锌粉,锌可置换出铜,沉淀物中含有铜等,酸性溶液Ⅱ中加入适量的二氧化锰,可将将Fe2+氧化成Fe3+,然后加入碳酸盐调节溶液的pH,可促进铁离子、铝离子的水解,可生成氢氧化铁、氢氧化铝沉淀,溶液Ⅳ中含有Mn2+、Zn2+,电解,可生成MnO2和Zn.
(1)因增大反应接触面积,加快反应速率,则原料需加工成矿粉,故答案为:增大反应接触面积,加快反应速率;
(2)MnO2有较强的氧化性,在酸性溶液中能氧化金属硫化物生成硫单质,反应的化学方程式为MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S+2H2O,
故答案为:MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S+2H2O;
(3)由以上分析可知矿粉中加入稀硫酸酸浸,含有的金属阳离子有Mn2+、Fe3+、Zn2+、Cu2+、Al3+等,故答案为:Cu2+;Al3+;
(4)MnO2具有氧化性,酸性溶液(Ⅱ)中加入适量MnO2的作用是将Fe2+氧化成Fe3+,然后加入碳酸盐调节溶液的pH,可促进铁离子、铝离子的水解,可生成氢氧化铁、氢氧化铝沉淀,但不能引入新杂质,可用MnCO3、ZnCO3等,
故答案为:将Fe2+氧化成Fe3+; ②③;
(5)阳极发生氧化反应,Mn元素被氧化,阳极产物为MnO2,阴极析出Zn,若电解过程转移1mol电子,则析出0.5molZn,质量为32.5g,
故答案为:MnO2;32.5.
点评 本题考查物质分离和提纯,为高频考点,涉及难溶物的溶解平衡、离子检验、氧化还原反应等知识点,侧重考查基本原理,明确流程图中发生的反应及基本操作、物质的性质,题目难度中等.

 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案
| A. | 可与FeCl3溶液发生显色反应 | |
| B. | 分子中最少有4个碳原子共平面 | |
| C. | 能发生取代反应和银镜反应 | |
| D. | 与H2完全加成的物质的量之比为1:1 |
 以下元素均为短周期元素:
以下元素均为短周期元素:| 元素代号 | 相关信息 |
| M | 非金属元素,其气态氢化物的水溶液呈碱性 |
| A | A的单质与冷水剧烈反应,得到强碱性溶液 |
| B | B的原子最外层电子数是 内层电子数的三倍 |
| C | 在第三周期中,C的简单离子半径最小 |
| D | A、B、D组成的36电子的化合物X是家用消毒剂的主要成分 |
| E | 所有有机物中都含有E元素 |
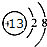 .
.(2)D的最低价含氧酸的电子式
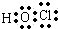 .
.(3)M的简单气态氢化物与B的单质形成燃料电池(KOH为电解液),写出其负极反应方程式2NH3-6e-+6OH-═N2+6H2O.
(4)A在真空高压下能与由D、E组成的分子呈正四面体结构的化合物Y反应生成2种固体物质,其中一种是自然界中硬度最大的物质.该反应的化学方程式:4Na+CCl4$\frac{\underline{\;真空高压\;}}{\;}$4NaCl+C;
(5)仅由A、B、E组成的一种生活中的常用盐,其中A的质量分数为43%,其水溶液与D单质物质的量比为1:1反应的离子方程式为CO32-+Cl2+H2O=ClO-+Cl-+HCO-3.
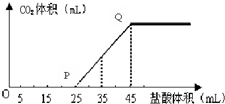
(6)A的最高价氧化物的水化物的溶液中通入一定量CO2得溶液X,X中逐滴加入1mol•L-1的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如图所示:
①X溶液中溶质的化学式NaOH和Na2CO3.
②当加入35mL盐酸时,产生CO2的体积为224mL(标准状况).
| A. | 58.5gNaCl溶解于1L水中配成的溶液,该溶液的物质的量浓度为1mol/L | |
| B. | 将22.4L的HCl气体溶于水,制成1L溶液,其浓度为1mol/L | |
| C. | 配制480ml 1.0mol/L的NaOH 溶液需要NaOH 固体20.0g | |
| D. | 中和100ml 1 1mol/L 的H2SO4溶液,需要NaOH 4g |