题目内容
 如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.
如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
(1)若X、Y是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞,则:
①X极附近观察到的现象是
②Y电极上的电极反应式是
(2)如果在铁件的表面镀铜以防止铁被腐蚀,电解液a选用CuSO4溶液,则:
①X电极对应的金属是
②若电镀前铁、铜两片金属质量相同,电镀完成后将它们取出洗净、烘干、称量,二者质量差为5.12g,则电镀时电路中通过的电子为
考点:电解原理
专题:电化学专题
分析:(1)电解饱和食盐水时,阳极上是氯离子失电子,阴极上是氢离子得电子生成氢气,剩余氢氧根显碱性遇酚酞变红;
(2)电镀时,镀层作阳极,镀件作阴极,阴极上得电子发生还原反应;在铁钉表面镀铜,根据电镀池工作原理可知,Fe作阴极,Cu作阳极,电镀时用含镀层金属的阳离子的盐做电解质溶液;根据金属质量和转移电子之间的关系式计算.
(2)电镀时,镀层作阳极,镀件作阴极,阴极上得电子发生还原反应;在铁钉表面镀铜,根据电镀池工作原理可知,Fe作阴极,Cu作阳极,电镀时用含镀层金属的阳离子的盐做电解质溶液;根据金属质量和转移电子之间的关系式计算.
解答:
解:(1)①和电源的负极相连的电极X极是阴极,该电极上氢离子发生得电子的还原反应,即2H++2e-=H2↑,所以该电极附近氢氧根浓度增大,碱性增强,滴入几滴酚酞试液会变红,故答案为:X极附近的溶液变成红色;
②和电源的正极相连的电极Y极是阳极,该电极上氯离子发生失电子的氧化反应,即2Cl--2e-=Cl2↑,故答案为:2Cl--2e-=Cl2↑;
(2)①在铁钉表面镀铜,Y作阳极的是镀层金属铜,反应式Cu-2e-=Cu2+;X做阴极的是待镀金属铁,X为阴极,电极反应为Cu2++2e-=Cu,
故答案为:铁;Cu2++2e-=Cu;
②阳极上铜质量减少,阴极上铜质量增加,二者质量差为5.12g时,阴极上析出铜的质量为2.56g,根据铜和转移电子之间的关系式知,转移电子的物质的量=
=0.08mol,故答案为:0.08;
②和电源的正极相连的电极Y极是阳极,该电极上氯离子发生失电子的氧化反应,即2Cl--2e-=Cl2↑,故答案为:2Cl--2e-=Cl2↑;
(2)①在铁钉表面镀铜,Y作阳极的是镀层金属铜,反应式Cu-2e-=Cu2+;X做阴极的是待镀金属铁,X为阴极,电极反应为Cu2++2e-=Cu,
故答案为:铁;Cu2++2e-=Cu;
②阳极上铜质量减少,阴极上铜质量增加,二者质量差为5.12g时,阴极上析出铜的质量为2.56g,根据铜和转移电子之间的关系式知,转移电子的物质的量=
| 2.56g |
| 64g/mol |
点评:本题考查了电解原理的分析应用,主要是电极反应和电极判断,电子守恒是电化学装置计算的依据,掌握基础是关键,题目较简单.

练习册系列答案
相关题目
取铜镁合金完全溶于浓硝酸中,反应过程中硝酸被还原只产生0.896L NO2气体和0.672LN2O4的气体(气体体积都已折算到标准状况),在反应后的溶液中加足量的氢氧化钠溶液,生成沉淀质量为3.7g.则合金中铜与镁的物质的量之比等于( )
| A、1:1 | B、2:1 |
| C、2:3 | D、3:2 |
现有CuO和Fe3O4的混合物7.6g,向其中加入1mol.L-l的H2SO4溶液100mL恰好完全反应,若将15.2g该混合物用足量CO还原,充分反应后剩余固体质量为( )
| A、13.6g |
| B、12g |
| C、6g |
| D、3.2 g |
50℃时,下列各溶液中,离子的物质的量浓度关系正确的是C( )
| A、pH=4的醋酸中:c(H+)=4.0mol?L-1 |
| B、pH=12的纯碱溶液中:c(OH-)=1.0×10-2mol?L-1 |
| C、饱和食盐水中:c(Na+)+c(H+)=c(Cl-)+c(OH-) |
| D、饱和小苏打溶液中:c(Na+)=c(HCO3-) |
由乙醇制乙二酸乙二酯最简单的正确流程途径顺序是( )
①取代反应 ②加成反应 ③氧化反应 ④还原反应 ⑤消去反应 ⑥酯化反应 ⑦水解反应.
①取代反应 ②加成反应 ③氧化反应 ④还原反应 ⑤消去反应 ⑥酯化反应 ⑦水解反应.
| A、①②③⑤⑦ |
| B、⑤②⑦③⑥ |
| C、⑤②①③④ |
| D、①②⑤③⑥ |
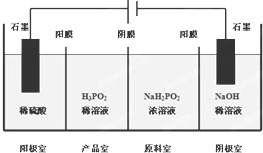 次磷酸(H3PO2)是一种精细磷化工产品,具有较强的还原性.回答下列问题:
次磷酸(H3PO2)是一种精细磷化工产品,具有较强的还原性.回答下列问题:

 (苯胺,易被氧化)
(苯胺,易被氧化) 有多种同分异构体,写出同时符合下列4个条件它的同分异构体的结构简式:
有多种同分异构体,写出同时符合下列4个条件它的同分异构体的结构简式: 的流程图:
的流程图: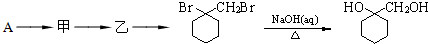 完成甲→乙的化学反应方程式:
完成甲→乙的化学反应方程式:
 为原料
为原料 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下: