题目内容
制备氢气可利用碘硫热化学循环法,其原理示意图如图1

(1)已知:2SO3(g)?2SO2 (g)+O2 (g)△H1
H2SO4(l)?SO3(g)+H2O(l)△H2
2H2SO4(l)?2SO2 (g)+O2(g)+2H2O(l)△H3
则△H3= (用△H1和△H2表示)
(2)上述热化学循环制氢要消耗大量的能量,从绿色化学角度,能量供应的方案是 .
(3)碘化氢热分解反应为:2HI(g)?H2(g)+I2(g)△H>0.则该反应平衡常数表达式:K= ;升温时平衡常数K (选填“增大”或“减小”)
(4)本生(Bunsen)反应中SO2和I2及H2O发生反应为:SO2+I2+2H2O=3H++HSO4─+2I─; I─+I2?I3─.
①当起始时,SO2为1mol,水为16mol,溶液中各离子变化关系如下图,图中a、b分别表示的离子是 、 .
②在水相中进行本生反应必须使水和碘显著过量,但易引起副反应将反应器堵塞.写出浓硫酸与HI发生反应生成硫和碘的化学方程式: .

(1)已知:2SO3(g)?2SO2 (g)+O2 (g)△H1
H2SO4(l)?SO3(g)+H2O(l)△H2
2H2SO4(l)?2SO2 (g)+O2(g)+2H2O(l)△H3
则△H3=
(2)上述热化学循环制氢要消耗大量的能量,从绿色化学角度,能量供应的方案是
(3)碘化氢热分解反应为:2HI(g)?H2(g)+I2(g)△H>0.则该反应平衡常数表达式:K=
(4)本生(Bunsen)反应中SO2和I2及H2O发生反应为:SO2+I2+2H2O=3H++HSO4─+2I─; I─+I2?I3─.
①当起始时,SO2为1mol,水为16mol,溶液中各离子变化关系如下图,图中a、b分别表示的离子是
②在水相中进行本生反应必须使水和碘显著过量,但易引起副反应将反应器堵塞.写出浓硫酸与HI发生反应生成硫和碘的化学方程式:
考点:用盖斯定律进行有关反应热的计算,化学平衡常数的含义,离子浓度大小的比较
专题:
分析:(1)根据盖斯定律计算;
(2)从能源角度考虑,用太阳能、风能、核能及生物质能等作为能源;
(3)根据平衡常数表达式等于生成物浓度的幂次方之积比上反应物浓度的幂次方之积书写;
由图象,升高温度,氢气增大,该反应向正反应方向移动,则平衡常数增大;
(4)①根据图象b为从零越来越大的离子,a为不变的离子,结合反应过程分析判断;
②根据氧化还原反应得失电子守恒书写浓硫酸与HI发生反应生成硫和碘的化学方程式;
(2)从能源角度考虑,用太阳能、风能、核能及生物质能等作为能源;
(3)根据平衡常数表达式等于生成物浓度的幂次方之积比上反应物浓度的幂次方之积书写;
由图象,升高温度,氢气增大,该反应向正反应方向移动,则平衡常数增大;
(4)①根据图象b为从零越来越大的离子,a为不变的离子,结合反应过程分析判断;
②根据氧化还原反应得失电子守恒书写浓硫酸与HI发生反应生成硫和碘的化学方程式;
解答:
解:(1)已知:①2SO3(g)?2SO2(g)+O2(g)△H1
②H2SO4(l)?SO3(g)+H2O(l)△H2
则①+②×2得,2H2SO4(l)?2SO2(g)+O2(g)+2H2O(l)△H3=△H1+2△H2.
故答案为:△H1+2△H2;
(2)从能源角度考虑,用太阳能、风能、核能及生物质能等作为能源,
故答案为:用廉价的清洁能源供给能量(用太阳能、风能、核能及生物质能等作为能源);
(3)由2HI(g)?H2(g)+I2(g),故K=
,由图象,升高温度,氢气增大,该反应向正反应方向移动,则平衡常数增大,
故答案为:
;增大;
(4)①由图象b为从零越来越大的离子,则根据SO2+I2+2H2O=3H++HSO4-+2I-,I-+I2?I3-,反应中越来越多的离子为I3-,反应过程中氢离子始终不变,
故答案为:H+、I3-;
②由氧化还原反应得失电子守恒,则浓硫酸与HI发生反应生成硫和碘的化学方程式为:6HI+H2SO4(浓)=3I2↓+S↓+4H2O;
故答案为:6HI+H2SO4(浓)=3I2↓+S↓+4H2O;
②H2SO4(l)?SO3(g)+H2O(l)△H2
则①+②×2得,2H2SO4(l)?2SO2(g)+O2(g)+2H2O(l)△H3=△H1+2△H2.
故答案为:△H1+2△H2;
(2)从能源角度考虑,用太阳能、风能、核能及生物质能等作为能源,
故答案为:用廉价的清洁能源供给能量(用太阳能、风能、核能及生物质能等作为能源);
(3)由2HI(g)?H2(g)+I2(g),故K=
| c(H2)c(I2) |
| c2(HI) |
故答案为:
| c(H2)c(I2) |
| c2(HI) |
(4)①由图象b为从零越来越大的离子,则根据SO2+I2+2H2O=3H++HSO4-+2I-,I-+I2?I3-,反应中越来越多的离子为I3-,反应过程中氢离子始终不变,
故答案为:H+、I3-;
②由氧化还原反应得失电子守恒,则浓硫酸与HI发生反应生成硫和碘的化学方程式为:6HI+H2SO4(浓)=3I2↓+S↓+4H2O;
故答案为:6HI+H2SO4(浓)=3I2↓+S↓+4H2O;
点评:本题主要考查了盖斯定律的应用,平衡常数的表达式及其判断以及电解池的原理,难度不大,注意方程式的书写.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
下列关于砷(As)元素的叙述中,正确的是( )
| A、第一电离能:As<Se,电负性As<Se |
| B、在AsCl3分子中,砷和氯原子核外电子数均为8 |
| C、砷酸的酸性比亚砷酸强,且砷酸钠溶液呈碱性 |
| D、AsH3的VSEPR模型为三角锥形,其中As原子采取sp3杂化 |
已知A、B、C、D、E是短周期原子序数依次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的最高正价与最低负价的代数和为零,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料.则有关说法正确的是( )
| A、元素A、C、D的单质均能与E的单质反应,且反应均为放热反应 |
| B、元素D的最高价氧化物与B、C、E的最高价氧化物对应的水化物之间均能发生反应 |
| C、化合物AE与CE含有相同类型的化学键 |
| D、元素B、D分别与E形成的化合物中每个原子最外层均满足8电子的稳定结构 |
 是一种重要的化工原料,其合成路线如下:
是一种重要的化工原料,其合成路线如下:
 反应的化学方程式为
反应的化学方程式为

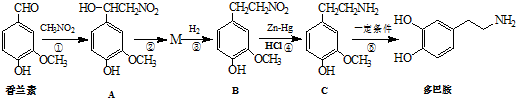
 )是生物体中重要的生物碱.写出用甲苯、硝基甲烷为原料制备苯乙胺的合成路线流程图(无机试剂任选).合成路线流程图示例如下:
)是生物体中重要的生物碱.写出用甲苯、硝基甲烷为原料制备苯乙胺的合成路线流程图(无机试剂任选).合成路线流程图示例如下: 实验室合成乙酸乙酯粗产品的步骤如下:
实验室合成乙酸乙酯粗产品的步骤如下: