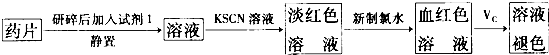
题目内容
下列图示与对应的叙述相符的是( )


| A、由图甲可以判断:T1>T2,且反应的△H<0 |
| B、图乙表示压强对可逆反应2A(g)+2 B(g)?3C(g)+D(s)的影响,乙的压强比甲的压强大 |
| C、根据图丙,若除去CuSO4溶液中的Fe2+,可先向溶液中加入适量双氧水,再调节pH≈4 |
| D、图丁表示用0.1mol/L的盐酸滴定20mL 0.1mol/LNaOH溶液,溶液pH随加入盐酸体积的变化 |
考点:反应热和焓变,化学平衡的影响因素,酸碱混合时的定性判断及有关ph的计算
专题:图示题
分析:A.放热反应随温度升高转化率降低,反应前后气体体积不变时正确;
B.压强越大,反应速率越大,达到平衡的时间越短,增大压强平衡向气体体积减小的方向移动;
C.图象分析,加入适量CuO至pH在3-4左右铁离子全部沉淀;
D.0.1mol/LNaOH溶液的pH=12.
B.压强越大,反应速率越大,达到平衡的时间越短,增大压强平衡向气体体积减小的方向移动;
C.图象分析,加入适量CuO至pH在3-4左右铁离子全部沉淀;
D.0.1mol/LNaOH溶液的pH=12.
解答:
解:A.若该反应是反应前后气体体积不变的放热反应,压强不影响平衡移动,升高温度,平衡向逆反应方向移动,A的转化率降低,不知道反应情况,故A错误;
B.该反应是反应前后气体体积减小的可逆反应,增大压强,平衡向正反应方向移动,反应物的含量减小,故B错误;
C.由图象可知pH在4左右时Fe3+完全转化为沉淀,而此时CuSO4没有生成沉淀,可用于除杂,故C正确;
D.0.1mol/LNaOH溶液的pH=12,故D错误;
故选C.
B.该反应是反应前后气体体积减小的可逆反应,增大压强,平衡向正反应方向移动,反应物的含量减小,故B错误;
C.由图象可知pH在4左右时Fe3+完全转化为沉淀,而此时CuSO4没有生成沉淀,可用于除杂,故C正确;
D.0.1mol/LNaOH溶液的pH=12,故D错误;
故选C.
点评:本题以图象形式,考查化学平衡影响因素、溶液PH值判断等,做题时要注意从图象中获取正确信息,综合性较强,难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
在合成氨工业中,为增加氨气的日产量,在过程中与平衡移动无关的是( )
| A、不断分离出液氨 |
| B、使用催化剂 |
| C、采用500℃的高温 |
| D、采用20-50Mp的压强 |
1体积pH=2.5的盐酸与10体积某一元强碱溶液恰好完全反应,则该碱溶液的pH等于( )
| A、9.5 | B、10.5 |
| C、11.5 | D、12.5 |
硫-钠原电池具有输出功率较高,循环寿命长等优点.其工作原理可表示为:2Na+xS
Na2Sx.但工作温度过高是这种高性能电池的缺陷,科学家研究发现,采用多硫化合物(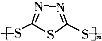 )作为电极反应材料,可有效地降低电池的工作温度,且原材料价廉、低毒,具有生物降解性.下列有关叙述正确的是( )
)作为电极反应材料,可有效地降低电池的工作温度,且原材料价廉、低毒,具有生物降解性.下列有关叙述正确的是( )
| 放电 |
| 充电 |
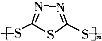 )作为电极反应材料,可有效地降低电池的工作温度,且原材料价廉、低毒,具有生物降解性.下列有关叙述正确的是( )
)作为电极反应材料,可有效地降低电池的工作温度,且原材料价廉、低毒,具有生物降解性.下列有关叙述正确的是( )A、多硫化合物(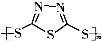 )是一种新型无机非金属材料 )是一种新型无机非金属材料 |
B、多硫化合物(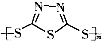 )化合物不能发生加成反应 )化合物不能发生加成反应 |
C、原电池的负极反应是将单体 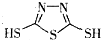 转化为 转化为 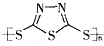 的过程 的过程 |
| D、当电路中有0.02mol电子通过时,原电池的负极将消耗原料0.46g |
已知反应:10AgF+5Cl2+5H2O=9AgCl+AgClO3+10HF+O2 下列关于该反应的叙述不正确的是( )
| A、该反应中,氧化剂与还原剂物质的量之比为9:5 | ||
B、当反应中有1mol电子转移时,被还原氯气物质的量为
| ||
| C、每产生1mol O2时,被氧元素还原的氯气物质的量为2mol | ||
D、参加反应的水有
|
设NA为阿伏加德罗常数,下列说法不正确的是( )
| A、1molNa变成Na+时失去的电子数为NA |
| B、12g12C中所含12C的数目为NA |
| C、CaCl2溶液中若含有1.5NA个Ca2+,则含有3NA个Cl- |
| D、11.2LN2中含有的氮原子数目为NA |
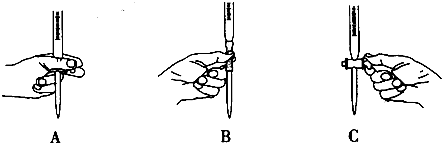
某同学在实验室进行了如图所示的实验,下列说法中错误的是( )

| A、利用过滤的方法,可将Z中固体与液体分离 |
| B、X、Z烧杯中分散质相同 |
| C、Y中反应的离子方程式为3CaCO3+2Fe3++3H2O=2Fe(OH)3+3 CO2↑+3 Ca2+ |
| D、Z中分散系能产生丁达尔效应 |
 工业上生产硫酸时,将SO2氧化为SO3是关键一步.
工业上生产硫酸时,将SO2氧化为SO3是关键一步.