题目内容
7.有A、B、C、D、F五种短周期元素,其中A、B、C属于同一周期,A原子最外层p能级的电子数等于次外层的电子数;B原子最外层中有两个不成对的电子;C原子核外有7个运动状态不同的电子;A、D同主族;B、E同主族;试回答:(1)写出D原子的电子排布式1s22s22p63s23p2
(2)B、C两元素的第一电离能较大的元素是:N,(填写元素符号),原因是N元素原子最外层p轨道为半满稳定状态,能量较低
(3)C的氢化物的立体结构为三角锥形,中心原子C的轨道杂化类型为sp3杂化,键角107°
(4)C的单质中π键的数目为2,B、D两元素的气态氢化物的稳定性由大到小的顺序是:H2O>SiH4(填写化学式).
分析 有A、B、C、D、F五种短周期元素,C原子核外有7个运动状态不同的电子,则为C为N元素;A、B、C属于同一周期,A原子最外层p能级的电子数等于次外层的电子数,A的核外电子排布为1s22s22p2,故A为碳元素,B原子最外层中有两个不成对的电子,B原子核外电子排布为1s22s22p4,故B为O元素;A、D同主族,则D为Si;B、E同主族,则E为S元素.
解答 解:有A、B、C、D、F五种短周期元素,C原子核外有7个运动状态不同的电子,则为C为N元素;A、B、C属于同一周期,A原子最外层p能级的电子数等于次外层的电子数,A的核外电子排布为1s22s22p2,故A为碳元素,B原子最外层中有两个不成对的电子,B原子核外电子排布为1s22s22p4,故B为O元素;A、D同主族,则D为Si;B、E同主族,则E为S元素.
(1)D为Si,原子的电子排布式为:1s22s22p63s23p2,故答案为:1s22s22p63s23p2;
(2)N元素原子最外层p轨道为半满稳定状态,能量较低,第一电离能高于氧元素的,
故答案为:N;N元素原子最外层p轨道为半满稳定状态,能量较低;
(3)C的氢化物为NH3,立体结构为三角锥形,中心原子N杂化轨道数目为4,杂化类型为sp3杂化,分子中键角107°,
故答案为:三角锥形;sp3杂化;107°;
(4)C的单质为N2,结构式为N≡N,分子中π键的数目为2,非金属性O>Si,故氢化物稳定性H2O>SiH4,
故答案为:2;H2O>SiH4.
点评 本题考查结构性质位置关系运用,涉及核外电子排布、电离能、空间结构与杂化方式判断、化学键、元素周期律运用等,注意同周期第一电离能异常情况.

练习册系列答案
相关题目
3.用导线将Fe和Cu连接置于同一稀硫酸溶液中,下列叙述正确的是( )
| A. | 正极附近c(H+)逐渐增大 | |
| B. | SO42-向正极移动 | |
| C. | 正、负极附近c(H+)基本不变 | |
| D. | Fe片、Cu片同时冒出气泡,则说明Zn片不纯 |
18.氨基甲酸铵(NH2COONH4)是一种白色固体,受热易分解.某小组模拟制备氨基甲酸铵,反应如下(且温度对反应的影响比较灵敏):2NH3(g)+CO2(g)?NH2COONH4(s)△H<0
(1)如用图I装置制取氨气,可选择的试剂是氯化铵与氢氧化钙.
(2)制备氨基甲酸铵的装置如图Ⅱ所示,把NH3和CO2通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵的小晶体悬浮在CCl4中.当悬浮物较多时,停止制备.
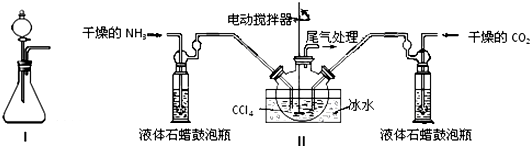
注:CCl4与液体石蜡均为惰性介质.
①发生器用冰水冷却的原因是防止反应放热使产物分解,提高反应物转化率,液体石蜡鼓泡瓶的作用是观察气泡调节NH3和CO2通入比例,控制反应速率.
②从反应后的混合物中分离出产品的实验方法是过滤(填写操作名称).为了得到干燥产品,应采取的方法是c(填写选项序号).
a.常压加热烘干 b.高压加热烘干 c.减压40℃以下烘干
(3)制得的氨基甲酸铵可能含有碳酸氢铵、碳酸铵中的一种或两种.
①设计方案,进行成分探究,请填写表中空格.
限选试剂:蒸馏水、稀HNO3、BaCl2溶液、澄清石灰水、AgNO3溶液、稀盐酸.
②根据①的结论:取氨基甲酸铵样品3.95g,用足量氢氧化钡溶液充分处理后,过滤、洗涤、干燥,测得沉淀质量为1.97g.则样品中氨基甲酸铵的物质的量分数为80%.[Mr(NH2COONH4)=78、Mr(NH4HCO3)=79、Mr(BaCO3)=197].
(1)如用图I装置制取氨气,可选择的试剂是氯化铵与氢氧化钙.
(2)制备氨基甲酸铵的装置如图Ⅱ所示,把NH3和CO2通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵的小晶体悬浮在CCl4中.当悬浮物较多时,停止制备.

注:CCl4与液体石蜡均为惰性介质.
①发生器用冰水冷却的原因是防止反应放热使产物分解,提高反应物转化率,液体石蜡鼓泡瓶的作用是观察气泡调节NH3和CO2通入比例,控制反应速率.
②从反应后的混合物中分离出产品的实验方法是过滤(填写操作名称).为了得到干燥产品,应采取的方法是c(填写选项序号).
a.常压加热烘干 b.高压加热烘干 c.减压40℃以下烘干
(3)制得的氨基甲酸铵可能含有碳酸氢铵、碳酸铵中的一种或两种.
①设计方案,进行成分探究,请填写表中空格.
限选试剂:蒸馏水、稀HNO3、BaCl2溶液、澄清石灰水、AgNO3溶液、稀盐酸.
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量固体样品于试管中,加入蒸馏水至固体溶解. | 得到无色溶液 |
| 步骤2:向试管中加入过量的BaCl2溶液,静置 | 若溶液不变浑浊,证明固体中不含碳酸铵. |
| 步骤3:向试管中继续加入:_______. | _______,证明固体中含有碳酸氢铵. |
15.下列各电子式中正确的是( )
| A. | 氯原子 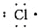 | B. | 氟原子 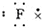 | C. | 溴化钡 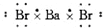 | D. | 硫化钾 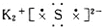 |
12.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 在pH=1的溶液中:K+、Na+、SO42-、HCO3- | |
| B. | 在0.1 mol•L-1 Na2CO3溶液中:Al3+、K+、NO3-、SO42- | |
| C. | 在0.1 mol•L-1 FeCl3溶液中:K+、NH4+、I-、SCN- | |
| D. | 在pH=12的溶液中:K+、Na+、ClO-、NO3- |
19.下列说法中正确的是( )
| A. | 所有的原子核内都有质子和中子 | |
| B. | (H+)实质上是一个裸露的质子 | |
| C. | 核外电子排布相同的微粒,其化学性质也相同 | |
| D. | 非金属元素原子最外层电子数都大于4 |
16.某芳香族有机物的分子式为C8H6O2,它的分子(除苯环外不含其他环)中可能有( )
| A. | 两个羟基 | B. | 一个酯基 | C. | 两个醛基 | D. | 一个羧基 |
17.下列物质是苯的同系物的是( )
| A. |  | B. |  | C. |  | D. |  |