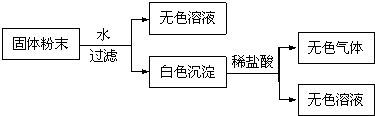
题目内容
 A、B、C、D、E五种溶液分别是NaOH、NH3?H2O、CH3COOH、HCl、NH4HSO4中的一种.常温下进行下列实验:
A、B、C、D、E五种溶液分别是NaOH、NH3?H2O、CH3COOH、HCl、NH4HSO4中的一种.常温下进行下列实验:①将1L pH=3的A溶液分别与0.001mol?L-1x L B溶液、0.001mol?L-1y L D溶液充分反应至中性,x、y大小关系为:y<x
②浓度均为0.1mol?L-1A和E溶液,pH:A<E;
③浓度均为0.1mol?L-1C与D溶液等体积混合,溶液呈酸性.
回答下列问题:
(1)D是
(2)用水稀释0.1mol?L-1B时,溶液中随着水量的增加而减小的是
①
| c(B) |
| c(OH-) |
| c(OH-) |
| c(H+) |
(3)OH-浓度相同的等体积的两份溶液A和E,分别与锌粉反应,若最后仅有一份溶液中存在锌粉,且放出氢气的质量相同,则下列说法正确的是
①反应所需要的时间E>A
②开始反应时的速率A>E
③参加反应的锌粉物质的量A=E
④反应过程的平均速率E>A
⑤A溶液里有锌粉剩余
⑥E溶液里有锌粉剩余
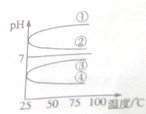
(4)将等体积、等物质的量浓度B和C混合后,升高温度(溶质不会分解)则混合溶液pH随温度变化如图中
考点:无机物的推断
专题:
分析:五种物质中NaOH、NH3?H2O显碱性,CH3COOH、HCl、NH4HSO4均显酸性,前两种五种与后三种物质等物质的量反应,但生成物一种酸性,一种中性的,只有与HCl反应,NaCl溶液显中性,NH4Cl显酸性,则A为HCl、B为NH 3?H2O、D为NaOH;浓度均为0.1mol?L-1C与D溶液等体积混合,溶液呈酸性,所以C为NH4HSO4,则E为CH3COOH.
熟练掌握各种物质形成溶液时的酸碱性及若电解质溶液稀释时,离子浓度的变化;掌握强酸与弱酸的比较,与金属反应开始后弱酸还能电离,从而导致的反应速率的比较;能够从溶质变化的角度分析混合溶液中离子浓度的大小.
熟练掌握各种物质形成溶液时的酸碱性及若电解质溶液稀释时,离子浓度的变化;掌握强酸与弱酸的比较,与金属反应开始后弱酸还能电离,从而导致的反应速率的比较;能够从溶质变化的角度分析混合溶液中离子浓度的大小.
解答:
解:(1)五种物质中NaOH、NH3?H2O显碱性,CH3COOH、HCl、NH4HSO4均显酸性,前两种五种与后三种物质等物质的量反应,但生成物一种酸性,一种中性的,只有与HCl反应,NaCl溶液显中性,NH4Cl显酸性,则A为HCl、B为NH 3?H2O、D为NaOH;浓度均为0.1mol?L-1C与D溶液等体积混合,溶液呈酸性,所以C为NH4HSO4,则E为CH3COOH.
故答案为:NaOH;
(2)①由NH3?H2O?OH-+NH4+可知,加水促进电离,则n(NH3?H2O)减少,n(OH-)增大,则
=
减小,故①正确;
②由NH3?H2O?OH-+NH4+可知,加水促进电离,则n(NH3?H2O)减少,n(OH-)增大,c(NH3?H2O)、c(OH-)都减小,c(H+)减小,则
减小,故②正确;
③因加水稀释时,温度不变,则c(H+)和c(OH-)的乘积不变,故③错误;
④由NH3?H2O?OH-+NH4+可知,加水促进电离,OH-的物质的量增大,故④错误;
故答案为:①②;
(3)①根据酸能与锌反应得到氢气,随着反应的进行,CH3COOH不断电离出H+,反应速率比盐酸中快,产生的氢气一样多,反应所需要的时间HCl>CH3COOH,故①错误;
②根据酸能与锌反应得到氢气,开始溶液中c(H+)相等,反应时的速率HCl=CH3COOH,故②错误;
③根据酸能与锌反应得到氢气,若最后仅有一份溶液中存在锌,放出氢气的质量相同,说明盐酸中锌剩余,CH3COOH中锌完全反应,参加反应的锌的物质的量相等,故③正确;
④根据酸能与锌反应得到氢气,随着反应的进行,CH3COOH不断电离出H+,反应速率比盐酸中快,故④正确;
⑤根据酸能与锌反应得到氢气,若最后仅有一份溶液中存在锌,放出氢气的质量相同,说明盐酸中锌剩余,CH3COOH中锌完全反应,参加反应的锌的物质的量相等,故⑤正确;
⑥根据酸能与锌反应得到氢气,若最后仅有一份溶液中存在锌,放出氢气的质量相同,说明盐酸中锌剩余,CH3COOH中锌完全反应,参加反应的锌的物质的量相等,故⑥错误;
故答案为:③④⑤;
(4)等体积、等物质的量浓度NH3?H2O和与NH4HSO4混合后溶液发生反应:NH3?H2O+NH4HSO4=(NH4)2SO4+H2O,NH4)2SO4要发生水解:NH4++H2O?NH3?H2O+H+,溶液呈酸性,加热水解平衡正向移动,c(H+)增大,pH减小,故答案为:④.
故答案为:NaOH;
(2)①由NH3?H2O?OH-+NH4+可知,加水促进电离,则n(NH3?H2O)减少,n(OH-)增大,则
| c(NH3?H2O) |
| c(OH-) |
| n(NH3?H2O) |
| n(OH-) |
②由NH3?H2O?OH-+NH4+可知,加水促进电离,则n(NH3?H2O)减少,n(OH-)增大,c(NH3?H2O)、c(OH-)都减小,c(H+)减小,则
| c(OH-) |
| c(H+) |
③因加水稀释时,温度不变,则c(H+)和c(OH-)的乘积不变,故③错误;
④由NH3?H2O?OH-+NH4+可知,加水促进电离,OH-的物质的量增大,故④错误;
故答案为:①②;
(3)①根据酸能与锌反应得到氢气,随着反应的进行,CH3COOH不断电离出H+,反应速率比盐酸中快,产生的氢气一样多,反应所需要的时间HCl>CH3COOH,故①错误;
②根据酸能与锌反应得到氢气,开始溶液中c(H+)相等,反应时的速率HCl=CH3COOH,故②错误;
③根据酸能与锌反应得到氢气,若最后仅有一份溶液中存在锌,放出氢气的质量相同,说明盐酸中锌剩余,CH3COOH中锌完全反应,参加反应的锌的物质的量相等,故③正确;
④根据酸能与锌反应得到氢气,随着反应的进行,CH3COOH不断电离出H+,反应速率比盐酸中快,故④正确;
⑤根据酸能与锌反应得到氢气,若最后仅有一份溶液中存在锌,放出氢气的质量相同,说明盐酸中锌剩余,CH3COOH中锌完全反应,参加反应的锌的物质的量相等,故⑤正确;
⑥根据酸能与锌反应得到氢气,若最后仅有一份溶液中存在锌,放出氢气的质量相同,说明盐酸中锌剩余,CH3COOH中锌完全反应,参加反应的锌的物质的量相等,故⑥错误;
故答案为:③④⑤;
(4)等体积、等物质的量浓度NH3?H2O和与NH4HSO4混合后溶液发生反应:NH3?H2O+NH4HSO4=(NH4)2SO4+H2O,NH4)2SO4要发生水解:NH4++H2O?NH3?H2O+H+,溶液呈酸性,加热水解平衡正向移动,c(H+)增大,pH减小,故答案为:④.
点评:本题考查电解质溶液之间的反应,涉及到强电解质、弱电解质的电离、盐类的水解及溶液的pH值、离子浓度大小的比较等知识,解题时要善于利用溶质物质的量的变化去分析.

练习册系列答案
相关题目
现由含硫酸镁和泥沙的粗食盐提纯氯化钠,可将粗食盐溶于水,然后进行下列操作:①过滤②加过量氢氧化钠溶液③加适量盐酸④加过量Na2CO3溶液⑤加过量BaCl2溶液⑥蒸发结晶正确的操作顺序是( )
| A、②④⑤①③⑥ |
| B、⑤④②①③⑥ |
| C、⑤④②③①⑥ |
| D、②④⑤①③⑥ |
能说明0.1mol.L-1的NaHA溶液一定呈酸性的是( )
①稀释时,溶液中c(OH-)增大;②溶液的pH<7;③溶液中c(Na+)=c(A2-);④溶液可与等体积等物质的量浓度的NaOH溶液恰好反应.
①稀释时,溶液中c(OH-)增大;②溶液的pH<7;③溶液中c(Na+)=c(A2-);④溶液可与等体积等物质的量浓度的NaOH溶液恰好反应.
| A、①②③④ | B、①②③ |
| C、.①③ | D、②④ |
工业上用铝土矿(主要成分为Al2O3,含Fe2O3等杂质)为原料冶炼铝的工艺流程如下:
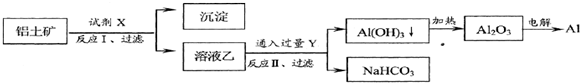
对上述流程中的判断正确的是( )

对上述流程中的判断正确的是( )
| A、试剂X为稀硫酸 |
| B、结合质子( H+)的能力由强到弱的顺序是:AlO2->OH->CO32- |
| C、反应II中生成Al(OH)3的反应为:CO2+AlO2-+2H2O=Al(OH)3↓+HCO3- |
| D、Al2O3熔点很高,工业上还可采用电解熔融AlCl3冶炼Al |
下列药物知识,不正确的是( )
| A、抗生素能抵抗所有细菌感染,可以大量使用 |
| B、肠溶片不可嚼碎服用,因为肠溶衣在碱性肠液下溶解才能发挥药效 |
| C、OTC是非处方药的标志,可以自行购药和按方使用 |
| D、凡不以医疗为目的滥用麻醉药品与精神药品都属于吸毒范围 |