题目内容
20.100mL、2mol•L-l硫酸跟过量的锌粉反应,在一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量的( )| A. | 醋酸钠 | B. | 硝酸钾 | C. | 硫酸铵 | D. | 硫酸铜 |
分析 过量的锌粉反应,硫酸完全反应,为了减缓反应速率但又不影响生成氢气的总量,可减小氢离子浓度但不改变其物质的量,以此来解答.
解答 解:A.加入醋酸钠固体,溶液中氢离子浓度降低,反应速率降低,但最终电离出氢离子物质的量不变,则生成氢气总量不变,故A正确;
B.加入硝酸钾溶液,硝酸和锌反应不生成氢气而生成氮氧化物,故B错误;
C.硫酸铵水解呈酸性,生成氢气的量增多,故C错误;
.D锌置换出铜,形成原电池反应,反应速率增大,故D错误.
故选A.
点评 本题考查化学反应速率影响因素,为高频考点,明确浓度、物质性质是解本题关键,易错选项是B,注意B中隐含条件,题目难度不大.

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目
6.对于反应A(g)+3B(g)?2C(g)+2D(g),下列四个数据是在不同条件下测出的该反应的化学反应速率,其中最快的是( )
| A. | v(D)=0.4mol/(L•S) | B. | v(C)=30mol/(L•min) | C. | v (B)=30mol/(L•min) | D. | v(A)=0.15mol/(L•S) |
11.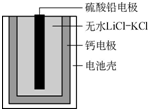 热激活电池可用作火箭、导弹的工作电源.该电池以Ca为负极,熔融无水LiCl-KCl混合物作电解质,结构如图所示.正极反应式为PbSO4+2Li++2e-═Li2SO4+Pb.下列说法不正确的是( )
热激活电池可用作火箭、导弹的工作电源.该电池以Ca为负极,熔融无水LiCl-KCl混合物作电解质,结构如图所示.正极反应式为PbSO4+2Li++2e-═Li2SO4+Pb.下列说法不正确的是( )
 热激活电池可用作火箭、导弹的工作电源.该电池以Ca为负极,熔融无水LiCl-KCl混合物作电解质,结构如图所示.正极反应式为PbSO4+2Li++2e-═Li2SO4+Pb.下列说法不正确的是( )
热激活电池可用作火箭、导弹的工作电源.该电池以Ca为负极,熔融无水LiCl-KCl混合物作电解质,结构如图所示.正极反应式为PbSO4+2Li++2e-═Li2SO4+Pb.下列说法不正确的是( )| A. | 该电池总反应为PbSO4+2LiCl+Ca═CaCl2+Li2SO4+Pb | |
| B. | 放电过程中,Li+向正极移动 | |
| C. | 每转移0.1mol电子,理论上生成20.7gPb | |
| D. | 常温下电解质是不导电的固体,电池不工作 |
15.在下列饱和溶液中分别持续通入CO2,始终不会有沉淀或晶体析出的是( )
| A. | Na2SiO3 | B. | Ca(OH)2 | C. | Ca(NO3)2 | D. | Na2CO3 |
5.欲将 转化为
转化为 ,可选用( )
,可选用( )
 转化为
转化为 ,可选用( )
,可选用( )| A. | CO2 | B. | NaHCO3 | C. | NaOH | D. | 盐酸 |
10.加入Al粉后会产生氢气的下列溶液中各组离子一定能大量共存的是( )
| A. | Na+、Al3+、Cl-、SO42- | B. | Na+、Mg2+、CO32-、Cl- | ||
| C. | K+、Ba2+、Cl-、Br- | D. | K+、Na+、SO42-、HCO3- |

