题目内容
未来生活中金属钛的运用会越来越广泛,例如可用TiO2作催化剂,用NaClO将CN-(毒性很强)氧化成CNO-,再在酸性条件下继续被NaClO氧化成N2和CO2.环保工作人员在密闭系统中用下图装置进行实验,以证明处理方法的有效性,并通过测定二氧化碳的量确定CN-被处理的百分率.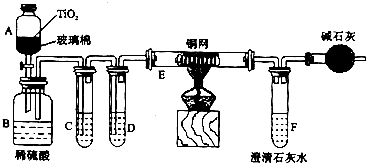
环保工作人员设计以下操作步骤:
Ⅰ.将浓缩后含CN-的污水与过量NaClO溶液的混合液共200mL(其中CN-的浓度为0.05mol/L)倒入A中,塞上橡皮塞.
Ⅱ.一段时间后,打开橡皮塞和活塞,使溶液全部放入B中,关闭活塞.请回答下列问题:
(1)装置B、C、D、E、F中有错误的是 (填字母),装置错误经改正后请简答(2)~(4)题.
(2)B中生成的气体除N2、H2O和CO2外,还有副产物HCl、Cl2.E用于除去Cl2,C中盛装的试剂是 ,装有碱石灰的干燥管的作用是 .
(3)B中反应的离子方程是 .
(4)F中盛有含Ca(OH)20.02mol的石灰水,若实验中F中共生成0.82g沉淀,则该实验中测得CN-被处理的百分率等于 .该测得值与工业实际处理的百分率相比总是偏低,请提出一个能提高准确度的建议(要有可操作性,且操作简单): .

环保工作人员设计以下操作步骤:
Ⅰ.将浓缩后含CN-的污水与过量NaClO溶液的混合液共200mL(其中CN-的浓度为0.05mol/L)倒入A中,塞上橡皮塞.
Ⅱ.一段时间后,打开橡皮塞和活塞,使溶液全部放入B中,关闭活塞.请回答下列问题:
(1)装置B、C、D、E、F中有错误的是
(2)B中生成的气体除N2、H2O和CO2外,还有副产物HCl、Cl2.E用于除去Cl2,C中盛装的试剂是
(3)B中反应的离子方程是
(4)F中盛有含Ca(OH)20.02mol的石灰水,若实验中F中共生成0.82g沉淀,则该实验中测得CN-被处理的百分率等于
考点:性质实验方案的设计
专题:
分析:(1)根据实验的原理,利用该装置气体经过溶液的流向分析判断;
(2)B中生成的气体除N2、H2O和CO2外,还有副产物HCl、Cl2.E用于除去Cl2,则C用于除去HCl,应用饱和食盐水,装有碱石灰的干燥管的作用是防止空气中的二氧化碳进入F中影响测定准确度;
(3)根据用TiO2作催化剂,用NaClO将CN-(毒性很强)氧化成CNO-,再在酸性条件下继续被NaClO氧化成N2和CO2,则在A里发生NaClO将CN-(毒性很强)氧化成CNO-,在B中发生NaClO氧化CNO-成N2和CO2,结合氧化还原反应得失电子守恒书写;
(4)根据碳原子守恒,计算出被处理的CN-的物质的量,再利用200mL(其中CN-的浓度0.05mol/L)求出CN-被处理的百分率;能提高准确度的建议有:控制CO2的产生速度,使装置中滞留的CO2尽可能多到与Ca(OH)2反应,将戊中澄清石灰水改为浓度较大到NaOH溶液,反应结束后戊中加入足量CaCl2后测沉淀质量等方面分析.
(2)B中生成的气体除N2、H2O和CO2外,还有副产物HCl、Cl2.E用于除去Cl2,则C用于除去HCl,应用饱和食盐水,装有碱石灰的干燥管的作用是防止空气中的二氧化碳进入F中影响测定准确度;
(3)根据用TiO2作催化剂,用NaClO将CN-(毒性很强)氧化成CNO-,再在酸性条件下继续被NaClO氧化成N2和CO2,则在A里发生NaClO将CN-(毒性很强)氧化成CNO-,在B中发生NaClO氧化CNO-成N2和CO2,结合氧化还原反应得失电子守恒书写;
(4)根据碳原子守恒,计算出被处理的CN-的物质的量,再利用200mL(其中CN-的浓度0.05mol/L)求出CN-被处理的百分率;能提高准确度的建议有:控制CO2的产生速度,使装置中滞留的CO2尽可能多到与Ca(OH)2反应,将戊中澄清石灰水改为浓度较大到NaOH溶液,反应结束后戊中加入足量CaCl2后测沉淀质量等方面分析.
解答:
解:(1)根据实验的原理,气体经过溶液时应长管进短管出,所以装置B、C、D、E、F中有错误的是B、F,
故答案为:B、F;
(2)B中生成的气体除N2、H2O和CO2外,还有副产物HCl、Cl2.E用于除去Cl2,则C用于除去HCl,应用饱和食盐水,装有碱石灰的干燥管的作用是防止空气中的二氧化碳进入F中影响测定准确度,
故答案为:饱和食盐水;防止空气中的二氧化碳进入F中影响测定准确度;
(3)根据题意可知,乙中的反应为酸性条件下CNO-与NaClO反应生成N2、CO2,反应离子方程式为2CNO-+2H++3ClO-=N2↑+2CO2↑+3Cl-+H2O,
故答案为:2CNO-+2H++3ClO-=N2↑+2CO2↑+3Cl-+H2O;
(4)200mL(其中CN-的浓度0.05mol/L)混合液中含有的CN-的物质的量是:0.2L×0.05mol/L=0.01mol,根据碳原子守恒,生成0.01mol二氧化碳,所以石灰水过量,生成的碳酸钙的物质的量是:0.0082mol,反应的CN-的物质的量是0.0082mol,CN-被处理的百分率是:
×100%=82%;
能提高准确度的建议有:建议一:不将A中溶液一次全部加入B中,改为分次加入,控制CO2的产生速度;
建议二:B中瓶塞改为三孔塞,增加的那个孔中插入一根导管到液面以下,反应结束后缓缓通入除去CO2的空气,使装置中滞留的CO2尽可能多到与Ca(OH)2反应.
建议三:将F中澄清石灰水改为浓度较大到NaOH溶液,反应结束后F中加入足量CaCl2后测沉淀质量等,
故答案为:82%;建议一:不将A中溶液一次全部加入B中,改为分次加入,控制CO2的产生速度;
建议二:B中瓶塞改为三孔塞,增加的那个孔中插入一根导管到液面以下,反应结束后缓缓通入除去CO2的空气,使装置中滞留的CO2尽可能多到与Ca(OH)2反应;
建议三:将F中澄清石灰水改为浓度较大到NaOH溶液,反应结束后F中加入足量CaCl2后测沉淀质量等.
故答案为:B、F;
(2)B中生成的气体除N2、H2O和CO2外,还有副产物HCl、Cl2.E用于除去Cl2,则C用于除去HCl,应用饱和食盐水,装有碱石灰的干燥管的作用是防止空气中的二氧化碳进入F中影响测定准确度,
故答案为:饱和食盐水;防止空气中的二氧化碳进入F中影响测定准确度;
(3)根据题意可知,乙中的反应为酸性条件下CNO-与NaClO反应生成N2、CO2,反应离子方程式为2CNO-+2H++3ClO-=N2↑+2CO2↑+3Cl-+H2O,
故答案为:2CNO-+2H++3ClO-=N2↑+2CO2↑+3Cl-+H2O;
(4)200mL(其中CN-的浓度0.05mol/L)混合液中含有的CN-的物质的量是:0.2L×0.05mol/L=0.01mol,根据碳原子守恒,生成0.01mol二氧化碳,所以石灰水过量,生成的碳酸钙的物质的量是:0.0082mol,反应的CN-的物质的量是0.0082mol,CN-被处理的百分率是:
| 0.0082mol |
| 0.01mol |
能提高准确度的建议有:建议一:不将A中溶液一次全部加入B中,改为分次加入,控制CO2的产生速度;
建议二:B中瓶塞改为三孔塞,增加的那个孔中插入一根导管到液面以下,反应结束后缓缓通入除去CO2的空气,使装置中滞留的CO2尽可能多到与Ca(OH)2反应.
建议三:将F中澄清石灰水改为浓度较大到NaOH溶液,反应结束后F中加入足量CaCl2后测沉淀质量等,
故答案为:82%;建议一:不将A中溶液一次全部加入B中,改为分次加入,控制CO2的产生速度;
建议二:B中瓶塞改为三孔塞,增加的那个孔中插入一根导管到液面以下,反应结束后缓缓通入除去CO2的空气,使装置中滞留的CO2尽可能多到与Ca(OH)2反应;
建议三:将F中澄清石灰水改为浓度较大到NaOH溶液,反应结束后F中加入足量CaCl2后测沉淀质量等.
点评:本题考查了电镀后的废水中CN-离子的含量测定,该题是高考中的常见题型,属于中等难度的试题,试题综合性强,侧重对学生能力的培养和训练,有利于培养学生规范严谨的实验设计、操作能力.

练习册系列答案
 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案 出彩同步大试卷系列答案
出彩同步大试卷系列答案
相关题目
 25℃时,用浓度为0.1000mol/L的NaOH溶液滴定20.00mL浓度均为0.1000mol/L的三种酸HX、HY、HZ,滴定曲线如图所示,下列说法正确的是( )
25℃时,用浓度为0.1000mol/L的NaOH溶液滴定20.00mL浓度均为0.1000mol/L的三种酸HX、HY、HZ,滴定曲线如图所示,下列说法正确的是( )| A、在相同温度下,同浓度的三种酸溶液的导电能力顺序:HX<HY<HZ | ||
| B、将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时,溶液中的离子浓度顺序:c(X-)>c(Y-)>c(OH-)>c(H+) | ||
| C、根据滴定曲线,可得Ka(HY)≈10-5 | ||
D、HY与HZ混合,达到平衡时:c(H+)=
|
下列物质属于电解质的是( )
| A、蔗糖 | B、熔融NaOH |
| C、NaCl溶液 | D、铜 |
海洋中有丰富的食品、矿产、能源、药物和水产资源,如图为海水利用的部分过程.下列有关说法正确的是( )


| A、用澄清的石灰水可鉴别NaHCO3和Na2CO3 |
| B、制取NaHCO3的反应是利用其溶解度小于NaCl |
| C、在第③、④、⑤步骤中,溴元素均被氧化 |
| D、工业上通过电解饱和MgCl2溶液制取金属镁 |
 如图是盐酸与氢氧化钠的滴定曲线a和b,试认真分析后填空:
如图是盐酸与氢氧化钠的滴定曲线a和b,试认真分析后填空: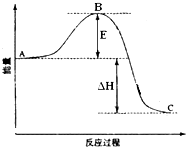 2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ?mol-1.请回答下列问题:
2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ?mol-1.请回答下列问题:
 Ⅰ.甲醇是一种新型的能源.
Ⅰ.甲醇是一种新型的能源.