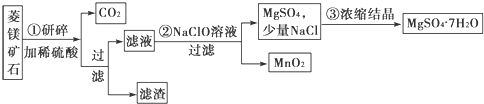
题目内容
2.下列离子方程式正确的是( )| A. | 向漂白液中通入少量二氧化碳:ClO-+H2O+CO2═${CO}_{3}^{2-}$+2HClO | |
| B. | 常温时偏铝酸钠溶液pH>7:${AlO}_{2}^{-}$+2H2O═Al(OH)3↓+OH- | |
| C. | 等物质的量浓度的FeI2溶液与溴水等体积混合:2Fe2++2I-+2Br2═2Fe3++I2+4Br- | |
| D. | 向硫酸氢钠溶液中滴加Ba(OH)2溶液恰好至沉淀完全:H++${SO}_{4}^{2-}$+Ba2++OH-═BaSO4↓+H2O |
分析 A.漂白液的主要成分为次氯酸钠,次氯酸的酸性大于碳酸氢根离子,二者反应生成次氯酸和碳酸氢根离子;
B.偏铝酸根离子的水解程度较小,不能使用沉淀符号,且应该用可逆号;
C.溴水不足,碘离子优先反应,亚铁离子不参与反应;
D.沉淀恰好完全时,硫酸氢钠与氢氧化钡按照物质的量1:1反应.
解答 解:A.HClO>HCO3-,则NaClO溶液中通入少量二氧化碳反应生成次氯酸和碳酸氢钠,正确的离子方程式为:ClO-+CO2+H2O═HClO+HCO3-,故A错误;
B.常温时偏铝酸钠溶液pH>7,偏铝酸根离子部分水解生成氢氧化铝和氢氧根离子,正确的离子方程式为:AlO2-+2H2O?Al(OH)3+OH-,故B错误;
C.等物质的量浓度的FeI2溶液与溴水等体积混合,溴和碘化亚铁的物质的量相等,溴不足,I-的还原性强于Fe2+,则碘离子优先被氧化,亚铁离子不反应,正确的离子方程式为:2I-+Br2═I2+2Br-,故C错误;
D.向硫酸氢钠溶液中滴加Ba(OH)2溶液恰好至沉淀完全,二者按照物质的量1:1反应,反应的离子方程式为:H++SO42-+Ba2++OH-═BaSO4↓+H2O,故D正确;
故选D.
点评 本题考查了离子方程式的书写判断,题目难度中等题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法,C为易错点,注意还原性强的碘离子优先反应.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
19.日常生活中有一种消毒液被广泛使用,该消毒液无色,pH大于7,对某些有色物质有漂白作用.从下列选项中选出你认为它可能的有效成分是( )
| A. | NaClO | B. | Na2CO3 | C. | KMnO4 | D. | H2O2 |
13.X、Y、Z、R、W是原子序数依次增大的五种短周期元素.Y和R同主族,可组成共价化合物,Y和Z最外层电子数之和与W的最外层电子数相同,25℃时0.01mol/LX和W形成 化合物的水溶液pH为2.下列说法不正确的是( )
| A. | Y、Z、W三种元素组成化合物的水溶液不一定显碱性 | |
| B. | 在Z、Y形成的两种离子化合物中阴阳离子的个数比分别均为1:2 | |
| C. | 原子半径由大到小排列的顺序是:Z>R>W>Y>X | |
| D. | 由于X、Y组成化合物分之间可以形成氢键,使X、Y组成化合物的稳定性高于X、R组成的化合物 |
17.室温下,HA、H2B两种酸溶液的浓度都是0.1mol•L-1,pH依次为1.5和2.0,则下列结论正确的是( )
| A. | H2B的酸性比HA的强 | |
| B. | 当NaA、NaHB、Na2B的溶液浓度都是0.1mol•L-1时,Na2B溶液pH最大 | |
| C. | HA和H2B不一定是弱酸 | |
| D. | 溶液中B2-、HB-、A-均能和强酸反应,也能和强碱反应 |
7.已知1个N2O3分子的质量为a g,1个N2O5分子的质量为b g.若以16O原子质量的$\frac{1}{16}$作为相对原子质量的标准,则NO2的相对分子质量为( )
| A. | $\frac{16(b+a)}{b-a}$ | B. | $\frac{16(b-a)}{b+a}$ | C. | $\frac{8(b+a)}{b-a}$ | D. | $\frac{8(b-a)}{b+a}$ |
14.以下说法正确的是( )
| A. | 石英玻璃是以纯碱、石灰石和二氧化硅为原料制成的 | |
| B. | 氮的固定是指将空气中游离的氮转变为氮的化合物的方法 | |
| C. | 绿色食品是指不含任何化学物质的食品 | |
| D. | 纳米材料是指一种称为“纳米”的新物质制成的材料 |
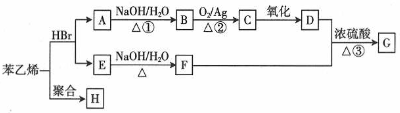
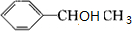 ;H的结构简式
;H的结构简式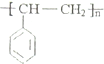 .
.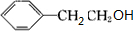 +O2$→_{△}^{Ag}$2
+O2$→_{△}^{Ag}$2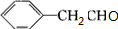 +2H2O ③
+2H2O ③ +
+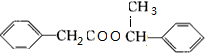 +H2O
+H2O .(任写一种)
.(任写一种)