题目内容
17.标准状况下,在干燥的烧瓶中充满纯净的NH3进行如图所示的喷泉实验下列说法错误的是( )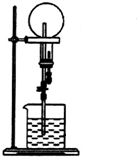
| A. | 若烧瓶的氨气中混有少量氮气,则喷泉实验后的水不能充满烧瓶 | |
| B. | 本实验之所以能够产生喷泉是因为氨气极易溶于水,导致烧瓶内外存在压强差 | |
| C. | 本实验若将NH3换成Cl2,烧杯中水换成饱和食盐水,也能产生喷泉 | |
| D. | 实验结束后烧瓶中氨水的物质的量浓度为$\frac{1}{22.4}$ mol•L-1 |
分析 A.氮气不溶于水,实验喷泉实验后烧瓶中有氮气;
B.形成喷泉实验利用烧瓶内与大气压的压强差,该实验利用的就是氨气极易溶于水的性质;
C.氯气不溶于饱和食盐水,也不与饱和食盐水反应;
D.设烧瓶容积为VL,根据n=$\frac{V}{{V}_{m}}$、c=$\frac{n}{V}$计算出实验结束后烧瓶中氨水的物质的量浓度.
解答 解:A.若烧瓶的氨气中混有少量氮气,由于氮气不溶于水,也不与水反应,则喷泉实验后的水不能充满烧瓶,故A正确;
B.氨气极易溶于水,从而导致烧瓶内外存在压强差,使烧瓶内气压迅速小于大气压,所以形成喷泉,故B正确;
C.若将NH3换成Cl2,烧杯中水换成饱和食盐水,则无法形成压强差,所以不能产生喷泉,故C错误;
D.设烧瓶容积为VL,则烧瓶内氨气的物质的量为:$\frac{VL}{22.4L/mol}$=$\frac{V}{22.4}$mol,实验结束后烧瓶中氨水的物质的量浓度为:c=$\frac{\frac{V}{22.4}mol}{VL}$=$\frac{1}{22.4}$mol/L,故D正确;
故选C.
点评 本题考查了喷泉实验原理及其应用,题目难度中等,明确喷泉实验原理为解答关键,试题侧重基础知识的考查,培养了学生的分析能力及化学实验、化学计算能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
8.把a、b、c、d四种金属片浸泡在电解质溶液中,用导线两两相连可以组成各种原电池.若a、b相连时,a为负极;c、d相连时,c不断溶解;a、c相连时,c产生气泡;b、d相连时,b增重,则这四种金属活动性顺序由大到小为( )
| A. | a>b>c>d | B. | a>c>d>b | C. | c>a>b>d | D. | b>d>c>a |
5.在一定温度下,将2mol SO2和1mol O2充入一定容积的密闭容器中,在催化剂作用下发生如下反应:2SO2(g)+O2(g)?2SO3(g);△H=-197kJ•mol-1,当达到化学平衡时,下列说法中正确的是( )
| A. | 生成SO3 2 mol | B. | SO2和SO3共2 mol | C. | 放出197 kJ热量 | D. | 含氧原子共8 mol |
12.表为元素周期表的一部分,X、Y、Z、R为短周期元素,其中Y元素的原子最外层电子数是其内层电子数的3倍.
下列说法正确的是( )
| X | Y | |
| Z | R | |
| W |
| A. | 原子半径大小关系为:R>Y>X | |
| B. | X有多种同素异形体,而Y不存在同素异形体 | |
| C. | 根据元素周期律,可以推测W元素的单质具有半导体特性,W2Y3具有氧化性和还原性 | |
| D. | ZY2晶体熔化、液态RY3气化均需克服分子间作用力 |
2.现有四种元素的基态原子的电子排布式如下:①1s22s22p63s23p2; ②1s22s22p63s23p4; ③1s22s22p5
则下列有关比较中不正确的是( )
则下列有关比较中不正确的是( )
| A. | 最高正化合价:③>②>① | B. | 原子半径:①>②>③ | ||
| C. | 电负性:③>②>① | D. | 第一电离能:③>②>① |
9.短周期元素X、Y、Z、W、Q在表中的位置如图所示,其中X元素的原子内层电子数是最外层电子数的一半,则下列说法中正确的是( )
| X | Y | ||
| Z | W | Q |
| A. | 钠与W可以形成离子化合物Na2W2 | |
| B. | 由Z与Y组成的物质在熔融时能导电 | |
| C. | 氧化物对应水化物的酸性:Q>W | |
| D. | 固态XY2和ZY2的化学键类型、晶体类型都相同 |
6.美国FDA证实,该国地质勘测局在内华达州法隆镇的一些奶牛场附近的井水中发现了84号元素Po(钋)的一种放射性致癌同位素.钋是目前已知最稀有的元素之一,下列有关它的说法正确的是( )
| A. | 门捷列夫能预测钋在地球上的分布 | B. | 钋在第七周期第ⅥA族 | ||
| C. | 钋的最外层电子数为6 | D. | 钋属于副族元素 |
7. 下表是某兴趣小组通过实验获得的相同体积足量稀硫酸与铁反应的实验数据:
下表是某兴趣小组通过实验获得的相同体积足量稀硫酸与铁反应的实验数据:
分析上述数据,回答下列问题:
(1)反应的离子方程式:Fe+2H+═Fe2++H2↑;
(2)①实验1、2可得出的结论是,硫酸浓度越稀,反应速率越慢;
②实验2、3可得出的结论是反应物接触面越大,反应速率越快;
③实验3、4可得出的结论是温度越高,反应速率越快.
(3)①用铁粉和稀硫酸反应制取H2,实验过程中绘制出生成H2的体积(V)与时间(t)的关系如图所示. 试分析判断OE段、EF段、FG段、GH段反应速率(分别用v (OE)、v (EF)、v (FG)、v (GH)表示)最快时段是B.
A.v (OE) B.v (EF)
C.v (FG) D.v (GH)
②1min内反应较慢的原因是:温度较低;一段时间后反应明显加快的原因是反应放热,使溶液的温度升高.
 下表是某兴趣小组通过实验获得的相同体积足量稀硫酸与铁反应的实验数据:
下表是某兴趣小组通过实验获得的相同体积足量稀硫酸与铁反应的实验数据:| 实验 序号 | 金属 质量/g | 金属 状态 | c(H2SO4) mol/L | 实验 温度/℃ | 金属消失 的时间/s | |
| 1 | 0.10 | 丝 | 0.7 | 20 | 250 | |
| 2 | 0.10 | 丝 | 1.0 | 20 | 200 | |
| 3 | 0.10 | 粉末 | 1.0 | 20 | 125 | |
| 4 | 0.10 | 粉末 | 1.0 | 30 | 50 |
(1)反应的离子方程式:Fe+2H+═Fe2++H2↑;
(2)①实验1、2可得出的结论是,硫酸浓度越稀,反应速率越慢;
②实验2、3可得出的结论是反应物接触面越大,反应速率越快;
③实验3、4可得出的结论是温度越高,反应速率越快.
(3)①用铁粉和稀硫酸反应制取H2,实验过程中绘制出生成H2的体积(V)与时间(t)的关系如图所示. 试分析判断OE段、EF段、FG段、GH段反应速率(分别用v (OE)、v (EF)、v (FG)、v (GH)表示)最快时段是B.
A.v (OE) B.v (EF)
C.v (FG) D.v (GH)
②1min内反应较慢的原因是:温度较低;一段时间后反应明显加快的原因是反应放热,使溶液的温度升高.
 工业上以黄铁矿为原料生产硫酸主要分为三个阶段进行,即煅烧、催化氧化、吸收.请回答下列问题:
工业上以黄铁矿为原料生产硫酸主要分为三个阶段进行,即煅烧、催化氧化、吸收.请回答下列问题: