题目内容
7.下列关于工业合成氨的叙述正确的是( )| A. | 合成氨工业温度选择为700K左右,只要是为了提高NH3产率 | |
| B. | 使用催化剂和施加高压,都能提高反应速率,但对化学平衡状态无影响 | |
| C. | 合成氨生产过程中将NH3液化分离,可提高N2、H2的转化率 | |
| D. | 合成氨工业中为了提高氢气的利用率,可适当增加氢气浓度 |
分析 A、合成氨反应为放热反应;
B、正反应是气体体积缩小的反应,所以增大压强平衡正移;
C、减少生成物的浓度平衡正向移动;
D、增加一种反应物的浓度提高另一种物质的转化率,而本身转化率降低.
解答 解:A、合成氨反应为放热反应,温度较高不利于提高原料利用率,故A错误;
B、催化剂和高压能加快反应速率,增大压强平衡正移,催化剂对平衡无响应,故B错误;
C、减少生成物的浓度平衡正向移动,所以将NH3液化分离,可提高N2、H2的转化率,故C正确;
D、增加一种反应物的浓度提高另一种物质的转化率,而本身转化率降低,所以合成氨工业中为了提高氢气的利用率,可增加氮气的浓度,故D错误;
故选C.
点评 本题考查了合成氨条件的选择,侧重于催化剂和压强对速率和平衡的影响,题目较简单.

练习册系列答案
 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案 导学教程高中新课标系列答案
导学教程高中新课标系列答案
相关题目
17.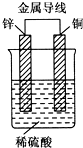 锌、铜和稀硫酸形成的原电池,某实验兴趣小组同学做完实验后,在读书卡片上记录如下:
锌、铜和稀硫酸形成的原电池,某实验兴趣小组同学做完实验后,在读书卡片上记录如下:
卡片上的描述合理的是( )
 锌、铜和稀硫酸形成的原电池,某实验兴趣小组同学做完实验后,在读书卡片上记录如下:
锌、铜和稀硫酸形成的原电池,某实验兴趣小组同学做完实验后,在读书卡片上记录如下:
卡片上的描述合理的是( )
| A. | ①②③ | B. | ③④⑤ | C. | ①⑤⑥ | D. | ②③④ |
18.铜板上铁铆钉处的吸氧腐蚀原理如图所示,下列有关说法不正确的是( )
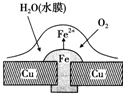

| A. | 正极的电极反应为:2H++2e-═H2↑ | |
| B. | 此过程中还涉及反应:4Fe(OH)2+2H2O+O2═4Fe(OH)3 | |
| C. | 此过程中铜并不被腐蚀 | |
| D. | 此过程中电子从Fe移向Cu |
2.下列操作中能使电离平衡H2O?H++OH-向右移动,且溶液中c(H+)增大的是( )
| A. | 向水中加入K2CO3溶液 | B. | 向水中加入AlCl3固体 | ||
| C. | 向水中加入NaHSO4溶液 | D. | 向水中加入NaOH固体 |
12.研究SO2、NOX、CO等大气污染气体的处理及利用的方法具有重要意义.
(1)火力发电厂的燃煤排烟中含大量的氮氧化物(NOX),可利用甲烷和NOX在一定条件下反应消除其污染.已知:
①N2(g)+O2(g)═2NO(g);△H1=180.5kJ•mol-1
②2NO(g)+O2(g)═2NO2(g);△H2=-113.0kJ•mol-1
③CH4(g)+2O2(g)═CO2(g)+2H2O(l);△H3=-889.5kJ•mol-1
则NO2与CH4转化成N2和H2O(l)的热化学方程式为2NO2(g)+CH4(g)=N2(g)+CO2(g)+2H2O(l)△H=-957kJ•mol-1.
(2)用活性炭还原法也可以处理氮氧化物,有关反应为C(s)+2NO(g)?N2(g)+CO2(g).一定温度下密闭容器中反应有关数据如下表:
①判断该反应达到平衡状态的标志是abd(填字母).
a.v正(NO)=2v逆(N2)
b.N2的浓度保持不变
c.容器中气体的压强不变
d.CO2的体积分数不变
②若平衡后升高温度 ,再次达到平衡测得容器中NO、N2、CO2的浓度值比为5:3:3,则△H<0(填“>”、“=”或“<”).
,再次达到平衡测得容器中NO、N2、CO2的浓度值比为5:3:3,则△H<0(填“>”、“=”或“<”).
(3)利用如图所示装置(电极均为惰性电极)也可吸收SO2,并用阴极排出的溶液吸收NO2.
①a为电源的正极(填“正极”或“负极”),阳极的电极反应式为SO2+2H2O-2e-=SO42-+4H+.
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有SO42-生成.该反应中氧化剂与还原剂的物质的量之比为1:2.
(1)火力发电厂的燃煤排烟中含大量的氮氧化物(NOX),可利用甲烷和NOX在一定条件下反应消除其污染.已知:
①N2(g)+O2(g)═2NO(g);△H1=180.5kJ•mol-1
②2NO(g)+O2(g)═2NO2(g);△H2=-113.0kJ•mol-1
③CH4(g)+2O2(g)═CO2(g)+2H2O(l);△H3=-889.5kJ•mol-1
则NO2与CH4转化成N2和H2O(l)的热化学方程式为2NO2(g)+CH4(g)=N2(g)+CO2(g)+2H2O(l)△H=-957kJ•mol-1.
(2)用活性炭还原法也可以处理氮氧化物,有关反应为C(s)+2NO(g)?N2(g)+CO2(g).一定温度下密闭容器中反应有关数据如下表:
| NO | N2 | CO2 | |
| 起始浓度/mol•L-1 | 0.10 | 0 | 0 |
| 平衡浓度/mol•L-1 | 0.04 | 0.03 | 0.03 |
a.v正(NO)=2v逆(N2)
b.N2的浓度保持不变
c.容器中气体的压强不变
d.CO2的体积分数不变
②若平衡后升高温度
 ,再次达到平衡测得容器中NO、N2、CO2的浓度值比为5:3:3,则△H<0(填“>”、“=”或“<”).
,再次达到平衡测得容器中NO、N2、CO2的浓度值比为5:3:3,则△H<0(填“>”、“=”或“<”).(3)利用如图所示装置(电极均为惰性电极)也可吸收SO2,并用阴极排出的溶液吸收NO2.
①a为电源的正极(填“正极”或“负极”),阳极的电极反应式为SO2+2H2O-2e-=SO42-+4H+.
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有SO42-生成.该反应中氧化剂与还原剂的物质的量之比为1:2.
19.下列物质属于含有共价键的离子化合物的是( )
| A. | MgCl2 | B. | Na202 | C. | K20 | D. | H202 |
17.生产、生活离不开各种化学物质,下列说法不正确的是( )
| A. | 过氧化钠和氧化钠均可用作潜艇中的供氧剂 | |
| B. | 明矾可用作除去污水中悬浮颗粒的絮凝剂 | |
| C. | 氧化铝可用来制造耐火坩埚 | |
| D. | 碳酸氢钠可用作治疗胃酸过多的药物及食品发酵剂 |