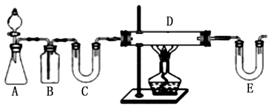
题目内容
17.下列说法正确的是( )| A. | 硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物 | |
| B. | 蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质 | |
| C. | 溶液中溶质粒子的运动有规律,胶体中分散质粒子的运动无规律,即布朗运动 | |
| D. | 由于2NO+2CO?2CO2+N2的△H<0,则该反应一定能自发进行 |
分析 A.纯碱是碳酸钠;
B.电解质是指在水溶液中或熔融状态下能够导电的化合物,水溶液中能完全电离的电解质为强电解质,水溶液中部分电离的电解质为弱电解质;非电解质是指在水溶液中和熔融状态下能够导电的化合物;、
C.溶质粒子和胶体中分散质粒子均作无规则运动;
D.反应自发进行的判断依据是△H-T△S<0,反应自发进行,△H-T△S>0,反应非自发进行;
解答 解:A.纯碱是碳酸钠,是盐不是碱,故A错误;
B.蔗糖是在水溶液中和熔融状态不导电、硫酸钡是盐熔融状态完全电离,水存在电离平衡分别属于非电解质、强电解质和弱电解质,故B正确;
C、溶液中溶质粒子和胶体中分散质粒子均作无规则运动,胶体粒子的无规则运动属于布朗运动,故C错误;
D.△H<0,但△S<0,△H-T△S不一定小于0,反应不一定自发进行,故D错误;
故选B.
点评 本题考查了物质组成、物质分类、胶体性质、反应蒸发进行的判断依据等知识点,掌握基础是解题关键,题目难度不大.

练习册系列答案
相关题目
7.某溶液中含有SO32-、CO32-、HCO3-、SO42-、Na+,向该溶液中加入足量的Na2O2,假设溶液体积变化忽略不计,下列说法不正确的是( )
| A. | 有气体生成 | |
| B. | Na+浓度基本不变 | |
| C. | HCO3-浓度减小而CO32-浓度增大 | |
| D. | SO32-发生反应的离子方程式为:SO32-+Na2O2+H2O=2Na++SO42-+2OH- |
8.常温下,往5%的H2O2溶液中滴加2~3滴FeCl3溶液,可发生如下两个反应:
①2Fe3++H2O2═2Fe2++O2↑+2H+②2Fe2++H2O2+2H+═2Fe3++2H2O
下列说法不正确的是( )
①2Fe3++H2O2═2Fe2++O2↑+2H+②2Fe2++H2O2+2H+═2Fe3++2H2O
下列说法不正确的是( )
| A. | Fe3+在反应①中作氧化剂,在反应②中为氧化产物 | |
| B. | 若生成标准状况下22.4 L O2,则整个过程中转移电子总数为2 mol | |
| C. | 在H2O2分解过程中,溶液的pH逐渐减小 | |
| D. | 在工业生产H2O2过程中要严格避免混入Fe3+ |
5.下列说法正确的是( )
| A. | 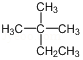 的系统命名为2-甲基-2-乙基丙烷 的系统命名为2-甲基-2-乙基丙烷 | |
| B. | 用酸性KMnO4溶液可以确定CH2=CH-CHO中含有C=C双键 | |
| C. | 在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH | |
| D. | 在一定条件下,乙酸、氨基乙酸、蛋白质均能与NaOH发生反应 |
12.下列关于物质性质的认识错误的是( )
| A. | 烟花燃放,五彩缤纷的焰火体现了某些金属元素的物理性质 | |
| B. | “雾霾天气”、“温室效应”、“光化学烟雾”的形成都与氮氧化物无关 | |
| C. | 淀粉和纤维素都能水解,水解最终产物都为葡萄糖 | |
| D. | 利用CO2合成聚碳酸酯类可降解塑料,实现“碳”的循环利用 |
9.设NA为阿伏加德罗常数的值,下列叙述不正确的是( )
| A. | 36g镁在足量的氮气中完全燃烧共转移的电子数为3NA | |
| B. | 室温下,21.0g乙烯和丁烯的混合气体中含有的C-H共价键数目为3NA | |
| C. | 标准状况下,44.8 L NO与22.4 LO2混合后气体中分子总数为3NA | |
| D. | 1 molNa2O和Na2O2混合物中含有的阴、阳离子总数是3NA |
6.通过乙醇制取氢气通常有如下两条途径:
a.CH3CH2OH(g)+H2O(g)=4H2(g)+2CO(g)△H1=+256.6kJ•mol-1
b.2CH3CH2OH(g)+O2(g)=6H2(g)+4CO(g)△H2=+27.6kJ•mol-1
则下列说法正确的是( )
a.CH3CH2OH(g)+H2O(g)=4H2(g)+2CO(g)△H1=+256.6kJ•mol-1
b.2CH3CH2OH(g)+O2(g)=6H2(g)+4CO(g)△H2=+27.6kJ•mol-1
则下列说法正确的是( )
| A. | 升高a的反应温度,乙醇的转化率增大 | |
| B. | 由b可知:乙醇的燃烧热为13.8 kJ•mol-1 | |
| C. | 2H2(g)+O2(g)=2H2O(g)△H=+485.6 kJ•mol-1 | |
| D. | 制取等量的氢气,途径b消耗的能量更多 |
7.Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2的反应类型是( )
| A. | 化合反应 | B. | 置换反应 | C. | 氧化还原反应 | D. | 复分解反应 |