题目内容
6.通过乙醇制取氢气通常有如下两条途径:a.CH3CH2OH(g)+H2O(g)=4H2(g)+2CO(g)△H1=+256.6kJ•mol-1
b.2CH3CH2OH(g)+O2(g)=6H2(g)+4CO(g)△H2=+27.6kJ•mol-1
则下列说法正确的是( )
| A. | 升高a的反应温度,乙醇的转化率增大 | |
| B. | 由b可知:乙醇的燃烧热为13.8 kJ•mol-1 | |
| C. | 2H2(g)+O2(g)=2H2O(g)△H=+485.6 kJ•mol-1 | |
| D. | 制取等量的氢气,途径b消耗的能量更多 |
分析 A.a为吸热反应,升高温度,平衡正向移动;
B.应生成稳定的氧化物;
C.氢气的燃烧为放热反应;
D.根据反应热计算.
解答 解:A.a为吸热反应,升高温度,平衡正向移动,则乙醇的转化率增大,故A正确;
B.燃烧热指应生成稳定的氧化物,应生成水、二氧化碳,故B错误;
C.氢气的燃烧为放热反应,△H<0,故C错误;
D.由热化学方程式可知生成1mol氢气,a吸收$\frac{256.6}{4}$kJ、b吸收$\frac{27.6}{6}$kJ,故D错误.
故选A.
点评 本题考查化学反应与能量变化,为高频考点,侧重于学生的分析能力和计算能力的考查,注意把握相关概念的理解,难度不大.

练习册系列答案
相关题目
16.如图,缓慢通入O2,用水吸收NO2(假设每次通入的O2能完全反应).下列说法正确的是( )
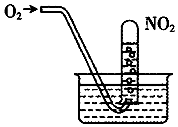

| A. | 当试管内溶液的pH值不再变化,说明NO2全部转化为HNO3 | |
| B. | 当试管气体不是红棕色时,说明NO2全部转化为HNO3 | |
| C. | 水槽内的水改为稀盐酸,有利于吸收NO2 | |
| D. | 水槽内的水改为稀NaOH溶液,有利于吸收NO2 |
17.下列说法正确的是( )
| A. | 硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物 | |
| B. | 蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质 | |
| C. | 溶液中溶质粒子的运动有规律,胶体中分散质粒子的运动无规律,即布朗运动 | |
| D. | 由于2NO+2CO?2CO2+N2的△H<0,则该反应一定能自发进行 |
14.已知700C时纯水KW=1×10-12,下列叙述正确的是( )
| A. | 700C时,向纯水中加人H3PO4后,水的Kw减小 | |
| B. | 700C的Na2CO3溶液中c(Na+)>c(CO32-)c(HCO3-)>c(OH-)>c(H+) | |
| C. | 700C的H2S04溶液中c(H+)=c(OH-)+2c(SO42-) | |
| D. | 将室温下0.1 mol/L的NaOH溶液加热至700C时,c(OH-)/c(H+)随之增大 |
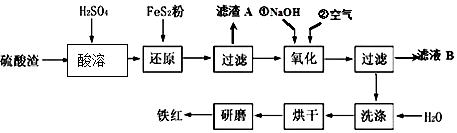
11.硫酸钙可用于生产硫酸、漂白粉等一系列物质(见图).下列说法正确的是( )
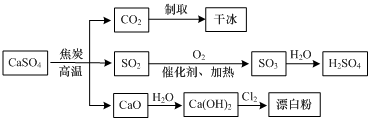

| A. | CO2制取干冰的过程吸收热量,属于物理变化 | |
| B. | 硫酸钙与焦炭反应时生成的n(CO2):n(SO2)=1:2 | |
| C. | 由SO2制取H2SO4的过程均为氧化还原反应 | |
| D. | 石灰乳与Cl2反应制取漂白粉时,Cl2仅作还原剂 |
15.比较等体积等物质的量浓度的NaClO(aq)与NaCl(aq)中离子总数多少( )
| A. | 前者大 | B. | 后者大 | C. | 两者一样 | D. | 无法确定 |
8. 将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3OCH3(g)+3H2O(l)
将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3OCH3(g)+3H2O(l)
(1)该反应的化学平衡常数表达式K=$\frac{c(C{H}_{3}OC{H}_{3})}{{c}^{2}(C{O}_{2}){c}^{6}({H}_{2})}$;
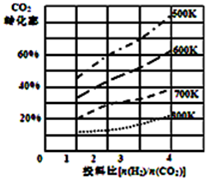
(2)已知在某压强下,该反应在不同温度、不同投料比时,达平衡时CO2的转化率如图所示:
①该反应的△H<0;(填“>”或“<”).
②若温度不变,减小反应投料比$\frac{n({H}_{2})}{n(C{O}_{2})}$,K值将不变(填“增大”、“减小”或“不变”);
③700K投料比$\frac{n({H}_{2})}{n(C{O}_{2})}$=2时,达平衡时H2的转化率a=45%;
(3)某温度下,向体积一定的密闭容器中通入CO2(g)与H2(g)发生上述反应,下列物理量不再发生变化时,能说明反应达到平衡状态的是ABC;
A.二氧化碳的浓度 B.容器中的压强
C.气体的密度 D.CH3OCH3与H2O的物质的量之比
(4)某温度下,在体积可变的密闭容器中,改变起始时加入各物质的量,在不同的压强下,平衡时CH3OCH3(g)的物质的量如表所示:
①P1>P2(填“>”“<”或“=”)
②X1=0.05mol
③P2下Ⅲ中CH3OCH3的平衡转化率为96%.
 将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3OCH3(g)+3H2O(l)
将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3OCH3(g)+3H2O(l)(1)该反应的化学平衡常数表达式K=$\frac{c(C{H}_{3}OC{H}_{3})}{{c}^{2}(C{O}_{2}){c}^{6}({H}_{2})}$;
(2)已知在某压强下,该反应在不同温度、不同投料比时,达平衡时CO2的转化率如图所示:
①该反应的△H<0;(填“>”或“<”).
②若温度不变,减小反应投料比$\frac{n({H}_{2})}{n(C{O}_{2})}$,K值将不变(填“增大”、“减小”或“不变”);
③700K投料比$\frac{n({H}_{2})}{n(C{O}_{2})}$=2时,达平衡时H2的转化率a=45%;
(3)某温度下,向体积一定的密闭容器中通入CO2(g)与H2(g)发生上述反应,下列物理量不再发生变化时,能说明反应达到平衡状态的是ABC;
A.二氧化碳的浓度 B.容器中的压强
C.气体的密度 D.CH3OCH3与H2O的物质的量之比
(4)某温度下,在体积可变的密闭容器中,改变起始时加入各物质的量,在不同的压强下,平衡时CH3OCH3(g)的物质的量如表所示:
| P1 | P2 | P3 | |
| I.2.0molCO2 6.0molH2 | 0.10mol | 0.04mol | 0.02mol |
| Ⅱ.1.0mol CO2 3.0molH2 | X1 | Y1 | Z1 |
| Ⅲ.1.0molCH3OCH3 3.0molH2O | X2 | Y3 | Z2 |
②X1=0.05mol
③P2下Ⅲ中CH3OCH3的平衡转化率为96%.