题目内容
10.与OHCCH2CH2CHO互为同系物且相对分子质量比其大28的同分异构体有( )| A. | 5种 | B. | 7种 | C. | 9种 | D. | 11种 |
分析 OHCCH2CH2CHO为1,4-丁二醛,与其为同系物,则含有2个醛基,相对分子质量大28,则多2个碳,据此判断即可.
解答 解:与OHCCH2CH2CHO互为同系物,且相对分子质量比其大28的为己二醛,碳架结构分别为:



 ,其中醛基只能连在链端,即
,其中醛基只能连在链端,即 只有一种,
只有一种, 有1、5和1、6两种,
有1、5和1、6两种, 有1、5和1、6两种,
有1、5和1、6两种, 有1、4和1、5和5、6三种,
有1、4和1、5和5、6三种, 有1、4一种,故总共有1+2+2+3+1=9种,故选C.
有1、4一种,故总共有1+2+2+3+1=9种,故选C.
点评 本题主要考查的是同分异构体的判断,掌握同系物的概念是解决本题的关键,难度不大.

练习册系列答案
相关题目
16.我国科研人员研制出一种新型的可充放电Cu/PbO2酸性单液流电池,该电池放电时的总反应为Cu+PbO2+2H2SO4═CuSO4+PbSO4+2H2O.下列说法不正确的是( )
| A. | 放电时的Cu为负极 | |
| B. | 充电时电解液的pH升高 | |
| C. | 充电时阳极电极反应为:PbSO4+2H2O-2e-═PbO2+4H++SO42- | |
| D. | 每消耗1molCu,电解质溶液中转移2mol电子 |
18.下列物质中,不能用于生活污水的净化的是( )
| A. | 明矾 | B. | 氯化铁 | C. | 硫酸铝 | D. | 氯化钠 |
5.某芳香化合物的分子式为C8H10,且其一氯代物有2种,则该有机物的二氯代物有( )
| A. | 7种 | B. | 8种 | C. | 9种 | D. | 10种 |
15.海水中蕴藏着丰富的资源,海水综合利用的流程图如图1:
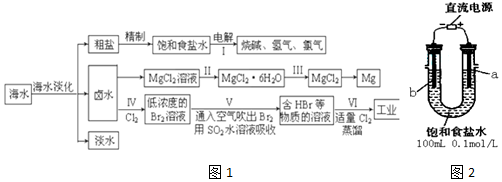
(一)某化学研究小组用图装置2模拟步骤I电解食盐水 (用铁和石墨做电极).
(1)a电极材料是石墨(填铁、石墨),其电极反应式为2Cl--2e-=Cl2↑.
(2)当阴极产生11.2mL气体时(标准状况),该溶液的pH为12(忽略反应前后溶液体积的变化).
(二)卤水中蕴含着丰富的镁资源,就MgCl2粗产品的提纯、镁的冶炼过程回答下列问题:已知MgCl2粗产品的溶液中含有Fe2+、Fe3+和Al3+. 表是生成氢氧化物沉淀的pH:
(3)把MgCl2粗产品的溶液中的Fe2+转化为Fe3+,最适宜选用的物质是b(填序号,下同),加入c调节溶液的pH,充分反应后过滤,可得MgCl2溶液.
a.KMnO4 b.H2O2 c.MgO d.NaOH
(4)步骤Ⅲ由MgCl2•H2O获得MgCl2的操作是:将MgCl2•6H2O在干燥的HCl气流中加热.

(一)某化学研究小组用图装置2模拟步骤I电解食盐水 (用铁和石墨做电极).
(1)a电极材料是石墨(填铁、石墨),其电极反应式为2Cl--2e-=Cl2↑.
(2)当阴极产生11.2mL气体时(标准状况),该溶液的pH为12(忽略反应前后溶液体积的变化).
(二)卤水中蕴含着丰富的镁资源,就MgCl2粗产品的提纯、镁的冶炼过程回答下列问题:已知MgCl2粗产品的溶液中含有Fe2+、Fe3+和Al3+. 表是生成氢氧化物沉淀的pH:
| 物质 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 8.1 | 3.8 | 9.5 |
| 完全沉淀pH | 3.7 | 9.6 | 4.8 | 11.0 |
a.KMnO4 b.H2O2 c.MgO d.NaOH
(4)步骤Ⅲ由MgCl2•H2O获得MgCl2的操作是:将MgCl2•6H2O在干燥的HCl气流中加热.
2.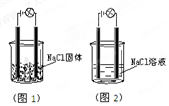 一化学兴趣小组在家中进行化学实验,按照图1连接好线路发现灯泡不亮,按照图2连接好线路发现灯泡亮,由此得出的结论正确的是( )
一化学兴趣小组在家中进行化学实验,按照图1连接好线路发现灯泡不亮,按照图2连接好线路发现灯泡亮,由此得出的结论正确的是( )
 一化学兴趣小组在家中进行化学实验,按照图1连接好线路发现灯泡不亮,按照图2连接好线路发现灯泡亮,由此得出的结论正确的是( )
一化学兴趣小组在家中进行化学实验,按照图1连接好线路发现灯泡不亮,按照图2连接好线路发现灯泡亮,由此得出的结论正确的是( )| A. | NaCl是非电解质 | B. | NaCl溶液是电解质 | ||
| C. | NaCl在水溶液中离子键发生断裂 | D. | NaCl溶液中水电离出大量的离子 |
13.在1200℃时,天然气脱硫工艺中会发生下列反应
H2S(g)+$\frac{3}{2}$O2(g)=SO2(g)+H2O(g)△H1
2H2S(g)+SO2(g)=S2(g)+2H2O (g)△H2
H2S(g)+O2(g)=S(g)+H2O(g)△H3
2S(g)=S2(g)△H4
则△H4的正确表达式为( )
H2S(g)+$\frac{3}{2}$O2(g)=SO2(g)+H2O(g)△H1
2H2S(g)+SO2(g)=S2(g)+2H2O (g)△H2
H2S(g)+O2(g)=S(g)+H2O(g)△H3
2S(g)=S2(g)△H4
则△H4的正确表达式为( )
| A. | △H4=$\frac{3}{2}$(△H1+△H2+3△H3) | B. | △H4=$\frac{2}{3}$(3△H3-△H1-△H2) | ||
| C. | △H4=$\frac{2}{3}$ (△H1+△H2-3△H3) | D. | △H4=$\frac{3}{2}$(△H1-△H2-3△H3) |